2018 심방세동 카테터 절제술 대한민국 진료지침: Part II
Abstract
In this part the writing group will cover strategies, techniques, and endpoints of atrial fibrillation (AF) ablation. Prior to all, electrical isolation of the pulmonary veins is recommended during all AF ablation procedures. In addition, techniques to be used for ablation of persistent and long-standing persistent AF, adjunctive ablation strategies, nonablative strategies to improve outcomes of AF ablation, and endpoints for ablation of paroxysmal, persistent, and long-standing persistent AF will be reviewed. Currently many technologies and tools are employed for AF ablation procedures. Radiofrequency energy, cryoablation, and other energy sources and tools are in various stages of development and/or clinical investigation. Finally, anticoagulation strategies pre-, during, and postcatheter ablation of AF and technical aspects of ablation to maximize safety are discussed in this section.
Key words: atrial fibrillation; ablation; strategy; technique; anticoagulation
I. 전략, 기술 및 목표점
역사적 고려사항
Cox와 그의 동료들은 심방세동의 수술적 절제술을 개발하고 그 효능을 입증하였다[ 1, 2]. 이후 외과의들은 폐정맥 격리술에 국한된 수술적 접근법의 효능을 평가했다[ 3, 4]. Cox에 의해 개발된 Maze-3 술식은, 부정맥의 지속을 위해서는 회귀를 위한 최소한의 순환 파형을 필요로 한다는 심방세동 모델을 기반으로 한다. 1990년대 초 Maze-3 수술의 성공으로 일부 심장 전기생리학자들은 고주파 카테터 절제술로 그 시술을 재현하려 시도했다. Swartz와 그의 동료들은 특수 설계된 도관과 고주파 절제 카테터를 사용하여 일부 환자에서 Maze-1 술식을 재현하였다. 하지만 효능에 비해 합병증 발생률이 높았으며 시술 시간 및 방사선 조사시간이 길었기에 이 방법은 오래 가지 못했다. 이들의 보고는 다른 연구자들로 하여금 심방세동의 카테터 기반 절제술을 개선하기 위해 노력하게 되는 동기를 부여했다. 결과적으로 많은 연구자들이 3차원 지도화 시스템이나 다극 절제 카테터 사용을 통해 외과적 Maze 술식을 재현하려 하였다. 이러한 임상 시험들은 제한된 성공을 거두었다[ 5- 9]. 이러한 배경 및 폐정맥 기반의 심방세동 초점 타깃을 목표로 하는 카테터 절제술의 급속한 진전으로 인해, 전기생리학자들은 외과적 Maze 술식의 다양한 측면 중 비 폐정맥 기반 선형적 절제술에 대한 접근법에 관심을 잃어갔다. Haissaguerre와 그의 동료들이 발견한 폐정맥 내 심방세동 유발 기전은, 카테터 절제술을 통해 유발 원점을 치료함으로써 심방세동 재발을 예방하는 방식을 발전시켰다[ 10- 14]. 그러나 심방세동 유발지점에 대한 직접적인 카테터 절제술은 심방세동의 개시가 반복적으로 유발되는 빈도가 크지 않을 경우 제한점이 많았다. 이러한 한계를 극복하기 위해 폐정맥을 전기적으로 격리시키도록 설계된 절제술이 도입되었다[ 14]. 3차원 전기해부학적 지도화를 이용해 폐정맥을 둘러 절제하는 전략은 Pappone 등에 의해 개발되었다[ 13, 15]. 폐정맥 내에서의 고주파 에너지 전달에 의한 합병증으로서의 폐정맥 협착 가능성 및 심방세동의 개시/유지 부위가 폐정맥동에 주로 위치한다는 것이 밝혀짐에 따라 폐정맥 자체 보다는 폐정맥동에 위치하는 심방조직을 표적으로 하는 절제술 전략의 변화를 야기했다[ 16, 17]. 폐정맥 원형 절제선은 3차원 전기해부학적 지도화 시스템[ 18, 19]이나 방사선투시장비[ 20], 또는 심내초음파검사[ 21] 유도 하에 시행되었다. 각 개별 폐정맥의 격리와 동측 폐정맥을 둘러싼 넓은 영역의 격리술을 비교한 무작위 연구에서, 전도 차단이 검증된 동측 폐정맥 원주 격리술이 개별 폐정맥 격리술에 비해 더 효과적인 심방세동 치료법임이 보고되었다[ 22]. 이 시술의 목표점은 절제된 영역 내의 전기신호 진폭 감소[ 18], 동측 폐정맥 내의 원형 지도화 카테터 또는 바스켓 카테터에서 기록된 폐정맥 전위의 소실 또는 해리[ 17, 19, 20, 23- 25] 및 폐정맥으로부터의 전기적 출구 차단[ 26] 등이었다. 폐정맥 격리술은 이제 심방세동 절제술의 기본 술식으로 널리 받아들여지고 있다[ 27]. 폐정맥의 전기적 격리는 모든 심방세동 절제술에서 권장된다 (Class I, LOE A) ( 표 1). 폐정맥 격리는 폐정맥 내에 위치한, 원형의 다전극 카테터에서 기록된 폐정맥 전위의 소실 또는 해리가 나타나는 것으로 정의할 수 있으며 95% 이상의 연구자들에서 심방세동 시술의 일차 목표점이다. 지속성 또는 장기 지속성 심방세동 환자에서 폐정맥 격리술만 단독으로 시행할 경우 재발률이 높기 때문에, 심방세동 절제술의 성과를 개선하기 위한 추가적인 전략을 세우려는 노력이 계속되고 있다. 이러한 전략에는 좌심방 및 우심방에 대한 선형 절제, 자율 신경절 절제, CFAE 절제, 비 폐정맥 초점 절제, 좌심방이 격리, 전압 지도화 또는 자기공명영상 상의 흉터 절제, 그리고 최근의 회전 활동에 대한 절제 등이 있다. 이러한 전략 중 일부 또는 전부가 심방세동 절제술의 검증된 표준 요소로 인정될 지의 여부는 시간이 지남에 따라 결정될 것이다. 최근의 STAR AF II 연구 결과에 따르면, 지속성 심방세동 환자에서 폐정맥 격리에 더하여 선형절제 또는 CFAE 절제를 추가하는 것은 심방세동 재발을 감소시키지 못했다[ 28]. 이 분야의 다른 발전사항으로는 냉각풍선 절제술 시스템의 도입과 접촉력 감지 절제 카테터의 도입을 들 수 있다. 다음으로는 이러한 접근법 및 기술을 설명하는 데이터들을 자세히 살펴볼 것이다.
고주파 에너지를 이용한 폐정맥 절제 접근법 및 영구적인 폐정맥 격리를 달성하기 위한 기술
영구적인 폐정맥의 전기적 격리는 심방세동 절제술의 기본으로 정립되어 있다. 이러한 목표점의 중요성에도 불구하고, 폐정맥의 영구적 격리는 달성하기가 쉽지 않다[ 29- 40]. 많은 연구에서 첫 번째 절제술의 실패 이후 반복적인 절제술 시행을 위해 전기생리학검사실로 돌아온 환자들 중 80% 이상에서 한 개 이상의 폐정맥 전도 재발이 있음을 보고하고 있다[ 29- 31, 36, 38]. 첫 번째 폐정맥 격리술 이후 심방세동 재발이 없는 환자에서 폐정맥 전기 재전도는 폐정맥내에서 절제술 후 소실되었던 폐정맥 전위가 다시 나타나는 것으로 알 수 있으며, 이러한 폐정맥 전도재발의 정도를 평가하는 연구도 수행되었다. 일부에서는 폐정맥 전도 재발율을 20% 미만으로 보고하기도 하였으나[ 29, 31], 대부분의 연구에서는 62%에서 90%에 걸쳐 높은 재전도율을 보고하였다[ 33, 38, 40]. 전기적 재전도의 시간 경과는 빨라 보이는데, 연구들에 따르면 급성 재전도율은 30분에 33% [ 32, 34, 35], 60분에 50% [ 41] 정도로 보고되어 있다. 본 섹션에서는 영구적 폐정맥 격리 비율을 높이기 위해 개발된 기술들에 대해 알아보고, 가장 널리 사용되는 접근법에 대한 의견을 제공할 것이다.
최적의 초기 병변 생성 및 대기 후 재확인
영구적인 폐정맥 격리를 얻을 가능성은 절제 에너지의 전달 및 병변 형성의 질과 관련되어 있음이 널리 알려져 있다. 병변의 크기 결정에 영향을 주는 요인은 다양하다. 고주파 에너지의 경우 카테터 안정성, 접촉력, 출력 강도, 온도 및 고주파 출력 기간 등이 병변의 크기와 깊이에 중요한 영향을 미친다는 것이 알려져 있다. 상기 각각의 요인들은 매우 중요하다. 저자들이 권고하기로는, 접촉력 감지 고주파 절제 카테터를 사용하는 경우 최소 5~10 그람 이상을 유지하는 것이 합당하다 (Class IIa, LOE C-LD) ( 표 1). 또한 고주파 절제술 중 식도 온도를 모니터링 하고 에너지 전달을 가이딩하기 위해 식도 온도 프로브를 사용하는 것이 권고된다(Class IIa, LOE C-EO) ( 표 1). 영구적인 폐정맥 격리율을 높이기 위한 방법 중 하나는 각 폐정맥을 모두 격리한 이후 20-30분간의 대기 시간을 두는 것이다. 시간에 따른 폐정맥 전도 재발율은 첫 30분 동안 가장 빈번하며, 이후 상당수가 60분 이내에 재 연결되고, 60분에서 90분 사이에는 거의 재발하지 않는다[ 32, 42- 44]. 재발성 심방세동으로 반복적인 고주파 절제술을 받은 환자를 대상으로 한 연구에 따르면, ROC 분석 결과 첫 시술 중 폐정맥 격리 후 관찰 시간과 만성 폐정맥 전도 재발율 간에 강한 음의 상관관계가 있었다[ 36]. 비록 진단의 정확도는 높지 않았지만 (민감도 66.9%, 특이도 60.6%), 최적의 컷오프 값은 35분이었다. 이상의 데이터를 통해 심방세동 고주파 절제술 시 20-30분의 대기 시간을 두는 것이 합리적인 것으로 판단된다. 물론 관찰 시간이 길어질수록 총 시술 시간도 그만큼 길어지고 전기생리학검사실 내 작업 흐름에도 영향을 주게 될 것이다. 저자들에 따르면 대략 80% 정도에서 심방세동 고주파 절제술 시 최소 20분의 대기시간을 둔다고 한다. 이상의 근거들을 토대로, 심방세동 고주파 절제술 시 폐정맥 격리 확인 후 20분 동안 폐정맥 전도 재발을 모니터링하는 것이 합리적이라고 할 수 있겠다 (Class IIa, LOE B-R) ( 표 1).
1. 전기적 격리를 달성하려면 최소한 폐정맥에 들어가는 전도 차단을 확인해야 한다. (I) 2. 초기 폐정맥 격리 확인 후 20분 동안 폐정맥 전도 재발을 모니터링하는 것이 합리적이다. (IIa) 3. 접촉력 감지 고주파 절제 카테터를 사용하는 경우 최소 5-10 그람 이상을 유지하는 것이 합당하다. (IIa)
아데노신 검사
아데노신 정주를 통해 일시적으로 세포 흥분성을 복원할 수 있으며 원형 폐정맥 격리선 안팎으로의 영구적인 전도 블록 또는 휴면 전도 (살아있지만 잠복 상태인)를 감별할 수 있다[ 45- 48]. 아데노신에 의한 휴면전도는 시술 후 폐정맥의 전도 재발을 예측하면 방법은 아데노신 정주 후, 폐정맥내에서 절제술 후 소실되었던 폐정맥 전위가 일시적 또는 지속적으로 다시 나타나는 것으로 확인할 수 있다. 이러한 아데노신의 효과는 아데노신 투여량뿐만 아니라 폐정맥 격리 후 경과 시간에 따라 다르게 나타난다[ 49]. 또한 동성 빈맥이나 저혈압과 같은 아데노신의 생리적인 효과를 보는 것만으로는 부족하며, 일시적인 방실 블록이 확인될 정도의 아데노신 양이 필요하다고 한다[ 49]. 여러 연구를 통해 영구적인 폐정맥 격리 및 심방세동 절제술의 결과를 개선시키기 위한 아데노신의 역할이 보고되었으며, 이는 최근의 한 종설에 정리되어 있다[ 50]. 다수의 연구들이 폐정맥 격리 20분 경과 이후 방실 블록 또는 3초 이상의 심실 휴지기를 동반할만한 양의 아데노신을 투여하는 것이 심방세동 절제술의 결과를 개선시킬 수 있음을 시사하지만, 이러한 전략의 효과는 제한적일 수 있으며 또한 이는 시술 시간의 증가와 비용 증가로 이어질 수 있다. 연구자들에 대한 조사에 따르면 심방세동 고주파 절제술 시에는 60% 정도에서 일상적으로 아데노신을 사용하며, 냉각풍선 절제술 시에는 25% 정도만이 아데노신을 사용한다고 한다. 이상의 근거들을 토대로, 폐정맥 격리 20분 경과 후 아데노신을 투여하는 것이 고려될 수 있겠다 (Class IIb, LOE B-R) ( 표 1).
이소프로테레놀 주입
몇몇 연구에서 폐정맥 휴면 전도를 드러내기 위해 이소프로테레놀 주입과 함께 아데노신을 사용하는 방법에 대해 보고되었다[ 51, 52]. 한 전향적 임상 시험에 따르면 아데노신이 이소프로테레놀 보다 우월하며, 두 약물 병용의 효과는 크지 않다고 한다[ 53]. 그러므로 이소프로테레놀은 비-폐정맥 트리거를 찾는 데에는 유용할 수 있으나, 폐정맥 격리 후 휴면 전도를 찾기 위한 방법으로는 제한적이라 할 수 있겠다.
절제 라인 상에서의 캡처 소실
폐정맥 격리술의 지속성을 향상시키기 위한 또 다른 방법으로 박동-캡쳐 유도 절제술 방식이 제안되었다[ 54- 56]. 일차적 폐정맥 격리 완료 후 동성 리듬인 상태에서 고주파 절제 카테터를 이용하여 원형 격리선을 따라 이동하며 10mA로 고출력 박동을 가하며, 캡쳐가 일어나는 지점에서는 추가적인 고주파 에너지 전달을 시행한다[ 55]. 최근의 무작위 배정 연구에서 이와 같은 방법은 전통적인 폐정맥 격리술에 비해 유의하게 부정맥 재발을 줄이는 것으로 나타났다[ 57]. 하지만 다른 방법들과 마찬가지로 이 전략 역시 시술 시간의 지연을 야기한다. 또한 이 방법은 냉각풍선 절제술 시에는 적용하기 힘들다.
출구 차단
폐정맥 격리에 있어 진입 전도 차단이 표준적인 목표점이겠으나, 출구 전도 차단은 폐정맥 유도 심방세동을 막기 위한 궁극적인 지향점이라고 할 수 있다. 출구 차단은 동성 리듬과 해리된 폐정맥 내 전기 활동의 존재를 확인하거나 폐정맥 내에서 박동을 가함으로써 확인가능하다[ 58]. 폐정맥 내 박동의 경우, 출구 차단을 증명하기 위해서는 좌심방에 전도되지 않는 국소 폐정맥 내 캡쳐를 시행하는 것이 필수적이다. 이 때 인접한 조직의 동반 캡쳐를 피하는 것이 중요한데, 이는 출구 전도가 남아있는 것으로 오인될 수 있기 때문이다[ 59]. 이에 대한 연구 결과들을 종합해 보면 진입 차단을 달성한 폐정맥 격리에 더하여 출구 차단을 확인하는 것은 합리적인 목표점으로 판단된다.
심방세동 절제술 시 폐정맥 격리에 더하여 추가적인 절제 전략
정맥-삼첨판 협부 (CTI) 절제술
정맥-삼첨판 협부를 포함하는 전형적인 심방조동의 카테터 절제술은 안전하고 효과적이며 입증된 방법이다. 심방세동 카테터 절제술을 시행받는 환자에서, 정맥-삼첨판 협부선은 약간의 시술 시간 연장만으로 안전하고 쉽게 시행할 수 있다. 저자 그룹의 조사에 따르면 정맥-삼첨판 협부의 절제술은 절제술 수행시에 유도가능한 정맥-삼첨판 협부 의존성 심방조동 뿐만 아니라, 이전에 정맥-삼첨판 협부 의존 심방조동의 심전도를 가진 환자의 94% 에서 시행되었다. 이것은 심방조동의 카테터 절제술의 안정성과 유효성을 나타내는 수십년간의 경험 및 절제술과 항부정맥제 치료와의 비교 임상 연구의 자료에 근거한다[ 60- 63]. 따라서 심방세동 절제술 시에 전형적인 심방조동이나 전형적인 심방조동의 과거력을 가진 환자의 경우, 정맥-삼첨판 협부 부위의 시술을 권고한다 (Class I, LOE B-R) ( 표 1).
정맥-삼첨판 협부를 포함하지 않는 선형 병변
폐정맥 원형 격리는 발작성 심방세동의 표준 치료이다. 그러나 폐정맥 격리만 시행한 지속성 심방세동이나 장기 지속성 심방세동 환자에서 높은 재발률이 관찰되기 때문에, 결과를 개선하기 위한 추가적인 전략을 수립하기 위한 지속적인 노력이 진행되고 있다. 이러한 전략들 중 하나는 좌심방에서 Cox-Maze III 병변 세트로 표현되는 부분과 유사한 추가 선형 병변을 만드는 것이다[ 64]. 선형 절제의 가장 보편적인 부위는 좌측 및 우측 상부 폐정맥 격리 병변의 상부를 연결하는 지붕 라인, 승모판과 좌하폐정맥 사이를 연결하는 승모협부 라인, 그리고 지붕라인과 승모 판막륜을 연결하는 전면부 라인을 포함한다[ 65, 66]. 조사에 따르면, 발작성 심방세동 환자의 첫 심방세동 절제술 시행시 2%만 선형 절제를 하는 것으로 보고된다. 발작성 심방세동 재시술의 경우, 저자 그룹의 10%가 선형 절제를 일상적으로 사용하였다. 이에, 거대 회귀 심방빈맥이 유발되지 않는 한 발작성 심방세동의 초기 또는 재 절제술시에 일상적인 선형 병변의 생성은 권장하지 않는다. 지속성 심방세동의 경우는 추가 병변의 역할은 논란의 여지가 남아있다[ 67, 68]. 지속성 심방세동의 절제 전략에 대해 최근 완료된 STAR-AF 연구는 폐정맥 격리 단독에 비해 선형 병변의 추가가 임상경과의 개선을 나타내지 않았다[ 28]. CHASE-AF 연구 역시 선형 병변의 추가가 폐정맥 격리 단독 시술에 비해 지속성 심방세동 절제술의 결과를 개선하지 못하였다[ 69]. 현재로서는 거대 회귀 심방조동이 없는 경우, 선형 절제 병변의 유용성은 충분히 확립되어 있지 않다. (Class IIb, LOE C-LD). 발작성 심방세동 환자의 경우 선형 절제를 해서는 안 된다. 지속성 또는 장기 지속성 심방세동의 초기 및 재 절제술 시 우심방이나 좌심방의 선형 절제 병변의 유용성은 잘 확립되어 있지 않다 (Class IIb, LOE B-NR) ( 표 1). 절제선 양측의 불완전한 차단이 심방빈맥 재발의 원인이 될 수 있음이 널리 알려져 있다[ 62, 70- 72]. 그러므로, 선형 절제 병변을 시행하는 경우, 라인 완성도를 평가하기 위해 지도화 및 박동 기법을 사용해야 한다 (Class I, LOE C-LD) ( 표 1). 장기 지속성 심방세동 환자의 경우, 단계적인 접근이 제안되기도 하였다[ 73]. 폐정맥 격리로 시작하고, 심방세동이 지속될 경우 심방빈맥이나 동성 리듬으로 변환하기 위한 CFAE 절제를 이후에 시행하는 것이다. 이러한 목표에 도달하지 못하는 경우, 추가적인 선형 절제를 시행한다[ 74, 75]. 심방세동의 종료를 목표로 하는 것은 장기 결과의 개선에 대해 논란의 여지가 있다[ 76]. 최근 데이터에서 선형 병변은 폐정맥 격리 단독 시술과 비교하여 결과의 개선을 보이지 않았다[ 28, 73, 77].
1. 거대 회귀 심방조동이 없는 경우, 선형 절제 병변의 유용성은 충분히 확립되어 있지 않다. (IIb) 2. 선형 절제 병변을 시행하는 경우, 라인 완성도를 평가하기 위해 지도화 및 박동 기법을 사용해야 한다. (I) 3. 지속성 또는 장기 지속성 심방세동의 초기 및 재 절제술 시 우심방이나 좌심방의 선형 절제 병변의 유용성은 잘 확립되어 있지 않다. (IIb)
좌심방 후벽 분리
일부 발작성 심방세동 환자는 폐정맥 격리 단독으로 치료할 수 있으나, 폐정맥 격리는 지속성 및 장기 지속성 심방세동을 제어하기에는 충분하지 않을 수 있다. 심방 기질의 추가 조절이 필요할 수 있으며, 이러한 전략의 한 방법으로 후벽의 전기적 격리가 제안되었다. 이것은 폐정맥 상부를 연결하는 좌심방 지붕라인과 하부정맥을 연결하는 하부라인을 만들어서 시행하거나 전체 후벽의 개별적 절제로 생성된다. 박스 병변의 진입 전도 차단은 박스 병변 내부의 전기적 신호 소실로 확인된다. 동성 리듬일 경우 박스 병변의 출구 차단은 박스 내부에서 자극신호를 주는 것으로 확인할 수 있다. 만약 절제선에 틈이 존재한다면 추가적으로 절제한다[ 78, 79]. 박스 외부의 좌심방이 켭쳐되지 않는다면, 완전히 격리된 것으로 판단한다. 박스 분리의 목표는 양방향 전도 (좌심방 캡쳐되지 않는 것과 박스 내부의 신호가 없는) 차단으로 정의된다. 비록 일부 연구에서는 후벽 분리로 결과의 개선을 보고하였으나, 다른 임상 연구에서는 결과의 개선이 보고되지 않았다[ 66, 80]. 최근에 발표된 BELIEF 연구에서는 장기 지속성 심방세동 환자에서 후벽 절제를 포함하는 광범위한 절제 전략이 28%에서 유효하다고 보고하였다[ 81, 82]. 발작성, 지속성 및 장기지속성 심방세동 환자의 첫 시술이나 재시술시에 후벽 분리를 고려할 수 있다고 제안한다 (Class IIb, LOE C-LD) ( 표 1 ).
비-폐정맥 트리거
폐정맥 외의 트리거는 심방세동 카테터 절제술을 위해 의뢰된 환자의 10%–33% 에서 보인다[ 10, 83- 87]. 비-폐정맥 트리거는 발작성, 지속성 심방세동 환자에서 심방세동을 유발할 수 있다[ 88]. 비-폐정맥 트리거의 흔한 부위는 좌심방 후벽, 상부 대정맥, 능선 종말판, 오목창, 관상정맥동, 유스타키안 능선, 마샬 인대, 대동맥판륜에 근접한 부위, 좌심방이 등에서 보고된다[ 83, 84, 86, 87, 89]. 이소프로테레놀은 비-폐정맥 트리거를 유발하기 위해 가장 많이 사용되는 약제이다. 최소한 24시간이상 베타차단제를 중지하고 항부정맥 약제를 반감기의 5배 이상 중지하는 것이 비-폐정맥 트리거를 찾는데 중요하다. 비-폐정맥 트리거를 찾는 전형적인 방법은 다음과 같다.
1. 평균 동맥압 > 70mmHg을 유지하기 위해 필요한 경우 혈관수축제 (페닐에프린 등)를 주입한다. 이것은 전신마취에서 더 중요하다. 주의 깊은 혈관 수축제의 사용으로 더 고용량의 이소프로테레놀의 사용이 가능하다. 2. 최소 10분 동안 분당 20-30 μg의 이소프로테레놀 점진적 주입이 권장된다. 3. 이소프로테레놀 주입에도 효과가 없으면, 고박동 조율을 통해 심방세동을 유발하고 저용량 이소프로테레놀 (2–6 μg/분) 주입중에 동율동 전환을 고려할 수 있다. 4. 첫 시작 박동만을 대상으로 할 때 비-폐정맥 트리거를 찾기는 어려울 수 있으며, 표면 심전도를 참고하고 우심방과 관상정맥동에 다극 도자를 위치하여 심방 내 활성도를 확인해야 한다[88,90]. 기외수축을 일으키지 않도록 세심하게 도관 조작을 하며, 좌심방 주변에서 원형 카테터나 절제 카테터를 움직이면서 심방세동의 재시작을 보는 것으로 심방세동의 트리거를 찾을 수 있다. 상대정맥 내부에 다극 도자를 위치하는 것은 상대정맥 트리거를 인지하는데 중요하다. 상대정맥 트리거가 인지되면 상대정맥 격리를 시행한다. 상대정맥 격리를 위해 상대 정맥 내부에 원형 지도화 도자를 위치시키고 절제술은 상대정맥/우심방 접합부에서 근위부로 시행한다. 상대정맥 격리 중에 늑간 신경 자극을 확인하기 위해 카테터 절제술 시행 전 고전압조율 (최소 20 mA)을 사용한다. 불완전한 분리가 되더라도 늑간신경 부위에서 절제술을 시행하는 것은 금기이다. 상대정맥 격리는 동결절 손상을 피하기 위해 이소프로테레놀의 효과가 없어진 후 동성 리듬에서 시행하는 것이 이상적이다. 동성맥박수의 갑작스런 증가 또는 동성 정지가 발생시에는 절제술을 중지해야 한다. 상대정맥 격리의 목표는 폐정맥 격리처럼 상대정맥으로의 진입 및 출구 차단이다.
좌심방 후벽에서 기원하는 심방세동 트리거를 절제할 때, 고주파 전력을 보통 30W 이하로 감소시킨다. 이를 위해 보통 시술 전 온도계를 식도에 위치시킨다[ 91, 92]. 이번 가이드라인에서도 역시 식도 손상 방지를 최소화 하기 위하여, 온도 감지계를 식도 내부에 위치시켜서 열에너지 전달 정도를 모니터링 할 것을 권고한다 (Class IIa, LOE C-EO) ( 표 1). 좌심방 후벽의 여러 곳에서 기원하는 심방세동 트리거가 확인될 경우, 좌심방 후벽 전체에 대하여 격리 시킬 것을 권고하기도 한다. 만일 심방세동 트리거가 관상정맥동 혹은 좌심방이에서 기원할 경우, 이번 가이드라인 제정에 참여한 인원들 대부분은 국소적으로 고주파 절제를 하는 편이지만, 일부에서는 위의 구조물들을 전기적으로 격리시키기도 한다. 좌심방이에서 기원하는 심방세동 트리거는, 좌상폐정맥 내부에 원형 지도화 카테터를 위치시켰을 때 좌심방이로부터의 원거리 신호가 관찰되는 것으로 확인할 수 있다. 좌심방이 격리술은 장기적인 혈전색전증 예방 치료의 필요성, 좌심방이 폐색술의 시행 가능성 등에 대하여 환자와 충분한 상의 후에 시행 여부를 결정해야 한다. 심방빈맥, 방실결절 회귀성 빈맥, 혹은 방실 회귀성 빈맥 등과 같은 비-폐정맥 트리거에 대해서는, 해당 특정 부위에 대한 국소적인 전극 도자 절제술을 시도할 수 있다. 반복적으로 이소프로테레놀 주입을 하여도 심방세동이 유발되지 않는 것이 시술의 종료점이 된다. 폐정맥 격리에 더하여 비-폐정맥 트리거들을 성공적으로 제거할 경우 재발률을 낮출 수 있다는 연구 결과들이 보고되었다[ 93- 95]. 일부 재시술을 받는 환자들에 있어 비-폐정맥 트리거가 유발되지 않는 경우, 특정 위치들에 경험적인 절제술이 시도될 수 있다. 이처럼 일반적인 유발 방법으로 심방세동이 잘 유발되지 않는 경우, 통상적으로 빈번하게 관찰되는 비-폐정맥 트리거에 대하여 경험적으로 절제술을 하는 것은 특히 만성 지속성 심방세동 환자에서 더 의미가 있다[ 96]. 이러한 방법 중 경험적으로 가장 흔히 시행되고 있는 것이 상대정맥 절제술이고, 그 외 승모판륜, 능선 종말판의 가장자리, 능선 종말판의 중간 혹은 아래 부분, 그리고 유스타키안 능선 등에 대한 절제술이 있다. 일부 연구자들은 경험적으로 좌심방이와 관상정맥동에 대한 절제술을 하기도 한다. 이러한 비-폐정맥 트리거를 제거하는 것이 재발률을 낮춘다는 근거에도 불구하고, 최근 유럽에서 조사된 바에 따르면 심방세동 시술 시 통상적으로 비-폐정맥 트리거를 인위적으로 자극하여 유발하고 절제하는 사람들은 그리 많지 않다[ 97]. 비-폐정맥 트리거에 대한 절제술은 특히 이미 폐정맥 격리가 완전히 되어 있는데도 불구하고 재시술을 받게 되는 지속성 심방세동 환자에서 특히 중요하다는 것을 다시 한 번 인지할 필요가 있다. 비-폐정맥 트리거가 잘 유발되지 않는 경우에 대한 이상적인 전략에 대해서는 추가 연구가 필요하다. 또한 비-폐정맥 트리거에 대한 절제를 첫 폐정맥 격리 시술 시 통상적으로 병행할 지, 아니면 재시술 시 시행할 지에 대해서도 역시 추가 연구가 필요하다. 현재까지의 연구결과들을 바탕으로, 발작성, 지속성, 장기 지속성 심방세동의 첫 시술 혹은 재시술 시 고용량의 이소프로테레놀을 주입하여 비-폐정맥 트리거를 찾아 절제술을 시도해보는 것을 고려해 볼 수 있다 (Class IIb, LOE C-LD).
1. 심방세동 절제술 시 폐정맥 입구 외부에서 반복적으로 심방세동을 유발하는 국소 트리거가 발견되면, 그러한 국소 트리거를 절제하는 것을 고려해야 한다. (IIa) 2. 발작성, 지속성, 장기 지속성 심방세동의 첫 시술 혹은 재시술 시 고용량의 이소프로테레놀을 주입하여 비-폐정맥 트리거를 찾아 절제술을 시도해보는 것을 고려해 볼 수 있다. (IIb)
국소 좌심방이 절제술, 격리, 결찰술 및 제거술
지난 5년여 간 좌심방이에서 기인하는 비-폐정맥 트리거를 찾아 절제술을 시행하는 다양한 방법에 대한 새로운 문헌들이 여럿 출간되었다. 시술 방법은 좌심방이에서 기인하는 비-폐정맥 트리거를 찾아 국소적으로 카테터 절제술을 시행하거나 좌심방이를 전기적으로 격리하는 것을 포함하고[ 98- 100], 최근에는 좌심방이 결찰술도 포함한다[ 86, 87, 90, 101]. 좌심방이 격리는 폐정맥 격리와 유사한 방법으로 기술되어 있다: 원형 지도화 카테터를 좌심방 입구에 위치시키고, 가급적 동율동에서 좌심방이가 활성화되는 가장 빠른 위치를 찾는다. 횡격막 신경 손상이나 좌심방이 천자의 위험성이 있어, 좌심방이 내부에 대한 전극도자 절제술은 절대 하지 않도록 각별히 유의해야 한다. 좌심방이 격리 이후에는 장기적으로 항응고제 복용을 하거나, 좌심방이 폐색술을 고려해야 한다. 이는 좌심방이 격리 이후로, 뇌졸중 위험성이 높아진다는 최근의 연구 결과에 따른 것이다[ 102]. 좌심방이 격리와 좌심방이 폐색술을 같이 시행하는 것에 대한 동물 연구와 사람 대상 연구가 최근 발표된 바 있다[ 99, 100]. LARIAT로 좌심방이 결찰술을 시행하는 것이 지속성 심방세동 환자에서 폐정맥 격리의 결과를 개선시킬지 여부에 대한 전향적 무작위 배정 임상 연구가 현재 진행 중이다.
복합 분획 심방 전기도 (Complex Fractionated Atrial Electrogram, CFAE) 절제술
10여년 전, 잠재적으로 심방세동을 유발 혹은 유지하는 기질일 가능성이 있는 CFAE를 겨냥한 심방세동 절제술 방법이 처음으로 기술되었다[ 74, 103]. 이러한 CFAE는 고도로 분절된, 혹은 매우 짧은(<120ms) 주기를 가지는 전기신호이다[ 104]. 일반적으로 CFAE는 0.06-0.25mV의 낮은 전압 범위에서 다분절의 전기 신호를 나타낸다. CFAE 절제술은 CFAE가 완전히 제거되거나 심방세동이 동율동으로 전환되는 것 (바로 동율동으로 전환되거나, 혹은 심방빈맥으로 먼저 전환되는 경우도 포함), 혹은 심방세동이 유발되지 않을 때를 일차적인 시술 종결점으로 한다. 지속성 심방세동 환자에서는 심방세동이 종료되는 것을 시술 종결점으로 한다. 비록 심방세동 종료라는 종결점이 단기간의 재발률을 감소시키기는 하지만, 장기적으로는 다소 실망스럽다는 내용이 보고된 바 있다[ 73, 75, 105, 106]. CFAE를 보이는 위치에서 해당 전기 신호가 완전히 제거된 후에도 심방조동이나 심방빈맥으로 부정맥이 지속되는 경우, 심방빈맥 유발 부위를 찾아서 전극 도자 절제술 하는 것이 필요하다[ 107]. 단계적 접근방법을 사용하여 장기 지속성 심방세동 환자 중 80% 이상에서 심방세동을 심방빈맥이나 동율동으로 전환시킬 수 있었다는 보고가 있다[ 108]. 하지만 이처럼 고무적인 단기간 성적에도 불구하고 장기 결과는 다소 실망스러운데, 1년 추적 시 재발하지 않은 환자가 35% 정도밖에 되지 않고, 5년 추적 시에는 17% 밖에 되지 않았던 결과도 보고된 바 있다[ 73]. 이러한 CFAE 절제술 방법의 제한점 중의 하나는, 광범위한 절제술이 필요하다는 것이다. 이로 인해 CFAE 부위를 “활동적인” 혹은 “비활동적인” 부위로 감별하는 방법이 기술된 바 있다. 이는 약물을 사용하거나, 단상 활동 전위를 사용하거나, 지속적으로 활성화된 전기 신호를 보이는 부위만을 대상으로 절제술을 진행하거나, 심방세동의 전기전도 활성 양상을 3차원적으로 재구성하는 방법 등을 포함한다[ 109- 111]. 불행하게도, 지속성 심방세동 환자에서 CFAE를 겨냥한 전극 도자 절제술이 재발률을 낮추는지에 대한 결과는 일관되지 않아서, 이 방법은 아직까지 논란의 여지가 많은 상태이다. 게다가, 지속성 심방 세동 589명을 대상으로 한 STAR AF II 연구에서는 폐정맥 격리에 더하여 선형 절제 혹은 CFAE 절제술이 시술 시간만 늘리면서 심방세동 재발률을 그다지 낮추지 못한다는 결과를 보고한 바 있다[ 28]. 지속성 심방세동 환자를 대상으로 시행한 CHASE-AF 연구에서도 유사한 결과를 보고하였는데, 폐정맥 격리만 시행한 환자들에 비하여, 선형 절제술과 CFAE 절제술을 추가로 시행한 경우 재발률에 차이가 없었다[ 69]. CFAE 절제술은 점차 설 곳을 잃어 가고 있으며 덜 광범위한 시술을 하는 방향으로 가고 있는 듯 하다[ 112]. 발작성 심방세동 환자에서 CFAE 절제술을 첫 시술 시 시행하는 것은 이번 가이드라인 제정에 참여한 인원들 중 아무도 지지하지 않았고, 재시술 시에는 4% 정도의 시술자들만 시도하는 것으로 나타났다. 이러한 정보와 출고된 문헌들을 바탕으로, 이번 가이드라인에서는 지속성 혹은 장기지속성 심방세동 환자에서 CFAE를 겨냥한 전극 도자 절제술을 첫 시술 시, 혹은 재 시술 시 시도하는 것에 대하여, 아직까지 잘 정립되어 있지 않다고 보았다 (Class IIb, LOE B-R). 주변의 선형 절제 부위와의 연결 없이 단순히 CFAE를 겨냥하여 일부 특정 부위에 대해서만 국소적으로 절제술을 시행하는 것은, 추후 심방조동 발생의 원인을 제공할 가능성이 있다. 발작성 심방세동 환자에서는 CFAE 절제술이 권고되지 않는다.
전압 지도화와 자기공명영상을 통해 확인된 섬유화 조직의 절제술
심방세동 절제술의 결과를 향상시키기 위해 개발된 또 다른 새로운 치료전략은 전압 지도화 또는 MRI를 기반으로 하여 얻은 섬유화 영역을 표적으로 하는 것이다. 폐정맥 격리와 결합한 이 접근법을 사용한 초기의 데이터는 고무적이었다. 이 접근법은 먼저 폐정맥을 격리하고, 이후 동율동에서 전압 지도를 기록한 다음 저전압 영역을 식별하고 격리한다. 이러한 절제선을 폐정맥 격리선에 연결하여 CFAE 또는 신경절 얼기 절제술과는 다르게 작은 채널의 생성을 방지하기 위한 노력이 이루어졌다. 이 접근법을 사용하여, 지속성 심방세동 환자의 약 1/3이 좌심방 섬유화를 가지지 않는 것으로 확인되었고, 따라서 단지 폐정맥 격리만 시행 되었다. 이 제한된 접근 방식으로 단일 시술에서 환자의 69%가 12개월간 심방세동의 재발을 보이지 않았고, 단지 1.2 회의 시술로 85%에서 재발이 없었다. 고주파 절제 카테터에 의해 형성된 병변의 내구성은 이 접근법에서도 여전히 중요한 문제이다. 최근 접촉력 측정 등의 기술 향상이 도움이 될 수 있을 것으로 보이나 이 시술법은 기본적으로 시술자의 풍부한 기술과 경험이 요구되는 방법이라 할 수 있다.
전기해부학적 전압 지도화로 섬유화 기질을 평가하는 방법 또한 집중적인 연구가 진행 중이나 아직 몇 가지 한계점이 남아 있다. 전압 지도화는 시간이 걸릴 뿐만 아니라, 측정된 전압은 리듬 상태, 전극과 조직의 접촉, 심방 심근의 두께, 지도화 전극의 크기, 전극간 거리 및 기타 변수에 영향을 받는다. 좌심방 흉터가 존재하는 것은 폐정맥 격리술 실패의 독립적 예측 인자로 알려져 있다[ 113]. 비정상적인 영역에 대한 기준으로 저전압은 ≤0.5 mV, 흉터 ≤0.05 mV로 정의했는데 이는 잡음과 구별하기 어렵다[ 114]. 심방의 섬유화는 하나의 스펙트럼으로 존재하기 때문에 이에 관한 절대적 기준은 있을 수 없다. 일반적으로 도자절제술 카테터로 평가하였을 때 심방의 흉터는 명확히 구별되는 전위가 없는 부위 및 박동시에 국소 캡쳐가 없는 것으로 제시되며 전압이 0.5 mV 이하면 섬유화 밀집 부위, 0.5-1.5 mV 이면 경증 섬유화 부위, 1.5 mV 이상이면 정상인 부위로 보고 있다. 최근에 지연증강 MRI가 심방 섬유화를 발견하고 정량화하며 위치를 파악하는데 이용되고 있다[ 115, 116]. MRI 상 좌심방 벽의 조직 특성은 전기해부학적 전압 지도화와 수술 생검 표본의 조직학과 상관 관계가 있었다. MRI 상 심방조직의 섬유화와 심방세동 카테터 절제술 결과의 연관성은 다기관 연구 (DECAAF) 에서 확인되었다[ 117]. 한편, 이러한 MRI 결과는 심방벽이 매우 얇기 때문에 좋은 영상을 얻기 위해 많은 기술적 경험을 필요로 하며 모든 기관에서 쉽게 재현되지 않는다는 문제점이 있다. 현재, MRI로 심방의 섬유화를 평가하기 위한 일관된 표준은 개발되지 않은 상태이나 일단 확립이 된다면, MRI를 통해 얻은 심방 섬유화의 위치 및 정도에 관한 정보가 환자 맞춤형 치료에 사용될 수 있을 것으로 예상된다. 마지막으로, 심방세동 고주파 카테터 절제술 전과 시행 중 그리고 직후에 심방조직의 변화를 관찰하기 위해 실시간 MRI를 전기생리학 검사실에 도입하는 것도 시도되고 있다. 현재 DECAAF-2 연구가 지속성 심방세동에서 폐정맥 격리 단독에 비해 MRI에서 발견된 흉터를 절제하는 것이 결과를 향상시킨다는 가설을 검증하기 위해 진행 중이다. 상기 정보와 문헌 검토를 토대로, 지속성 및 장기 지속성 심방세동의 초기 또는 반복 절제술 전략으로서 전압 지도화 또는 MRI로 식별된 비정상 심근 조직의 절제는 아직 근거가 확립되지 않은 상태이다(Class IIb, LOE B-R) ( 표 1).
회전 활동성 (Rotational Activity)의 지도화와 절제술
과거에 심방의 회전활동성 지도화 및 절제에 대한 접근법이 심방세동 절제술의 결과를 개선한다는 것을 보여주는 결과가 발표되었지만[ 118- 120], 최근의 연구들은 이러한 초기 발견을 확증하지는 못했다[ 121]. 회전 활동성의 지도화를 이용하는 FIRM 프로토콜과 관련된 문제점으로는, 바스켓 카테터 배치 및 적절한 전극 접촉이 어렵다는 점과 주위 조직에서 오는 신호와 회전활동성에서 오는 전기신호의 특성을 식별할 수 없다는 점이 있다. 이 절제 전략의 효능에 관한 논란은 계속되고 있어, 더 많은 연구가 필요하다[ 120, 122- 124]. 현재 이 접근법의 장기적인 안전성과 유효성을 평가하기 위한 몇 가지 전향적 무작위 임상연구가 진행 중이다. 다빈도의 회귀 소스는 심방세동 유지에 중요한 메커니즘이다. 최근 수십 또는 수백개의 기록 사이트를 동시에 수집하는 다중전극을 사용하여 심방세동 소스를 식별하고 치료하는 기술이 발전하고 있다. 여전히 개선의 여지는 있지만, 지도화 기술이 빠른 속도로 진화하고 있어 가까운 미래에 심방세동의 기전을 밝히는 획기적인 발전이 일어날 것으로 기대된다. 조사에 따르면 심방세동 환자의 첫 절제술 또는 반복 절제술 중에 통상적으로 회전활동성에 대한 절제술을 적용하지는 않는다고 한다. 현재로서는, 지속성 그리고 장기지속성 심방세동에 대한 초기 또는 반복 절제술 전략으로서 회전활동성의 절제술의 유용성이 잘 확립되어 있지 않다 (Class IIb, LOE B-NR) ( 표 1).
좌심방 신경절 얼기 (Ganglionated Plexi, GP) 절제술
최근 실험과 임상 연구 결과에 따르면 신경절 얼기의 상호연결된 클러스터에 의해 형성되는 내인성 심장 자율신경계가 심방세동의 개시 및 유지에 중요한 역할을 한다는 것이 밝혀졌다[ 125- 134]. 신경절 얼기는 CFAE 라고도 하는 고도로 분절된 심방 전기신호 (fractionated atrial potentials, FAP) 영역 내에 지속적으로 위치하기 때문에, 심방세동이 진행하는 동안 좌심방과 폐정맥의 분획맵에서 시작하는 것이 유용하다. 신경절 얼기는 대개 다음 4영역에 있다: (1) 좌심방이 능선 FAP 영역 (좌심방이와 좌측 폐정맥 사이); (2) 좌상방 FAP 영역; (3) 후하방 FAP 영역; (4) 우전방 FAP 영역. 신경절 얼기는 심방세동 동안 일시적 방실차단을 나타내는 위치를 식별하기 위해 고주파 자극을 사용할 수 있다. 양성 고주파자극 반응(일시적 방실 차단, 심방세동 동안 평균 R-R 간격의 >50% 증가)을 통해 5개의 주요 신경절 얼기를 확인할 수 있다. 신경절 얼기의 카테터 절제술을 위해, 양성 반응을 나타내는 각 부위에 고주파 에너지를 적용한다 (대개 30-60초 동안 25-35W, 그러나 식도에 가까울 때는 고주파 에너지 또는 시간 감소) [ 135]. 고주파 자극은 각 절제단계 후에 반복된다. 양성반응이 존재하는 경우, 반응이 소실될 때까지 고주파 에너지가 다시 적용된다. 5개의 신경절 얼기 영역 각각의 절제술은 보통 2-12회의 고주파 에너지 전달을 필요로 한다. 발작성 또는 지속성 심방세동 환자에서 신경절 얼기 절제는 지속하는 심방세동의 유도 가능성을 크게 감소시켰다. 신경절 얼기 절제 후 심방세동이 계속 유도되는 경우, 대개 신경절 얼기 절제는 전체 CFAE 영역보다 훨씬 작은 영역을 절제하더라도 대다수의 CFAE를 제거하는 경우가 많았다. 그러나 최근의 전향적 무작위 수술적 심방세동 절제술 연구에서 자율 신경절의 절제로 인한 결과의 개선은 없다고 보고되었다[ 136]. 하지만 신경절 얼기 절제선을 폐정맥 격리 또는 해부학적 구조에 의해 만들어진 비전도성 조직에 연결하는 것은 후속 심방 빈맥을 예방하는데 중요하다. 결론적으로, 발작성, 지속성 및 장기 지속성 심방세동의 처음 또는 반복 절제 전략으로서의 신경절 얼기 절제의 유용성은 아직 잘 확립되어 있지 않다 (Class IIb, LOE B-NR) ( 표 1).
우세빈도 (Dominant Frequency, DF) 지도화
심방세동 시 일반적으로 가장 짧은 파형 주기는 좌심방에서 측정 된다[ 137]. 위상차 지도화[ 138]와 우세빈도 지도화를 함께 사용하여 측정한 가장 높은 DF 값은 부정맥을 관장하는 회전 활동성의 위치와 가장 잘 부합 하였다[ 139]. 한 연구에 따르면 발작성 및 지속성 심방세동 환자에서 가장 높은 DF 값을 보이는 폐정맥을 고주파 절제 하였을 때에 89%의 환자에서 심방세동 주기길이가 5 ms 이상 증가하는 것으로 보고되었다[ 140]. 발작성 심방세동 환자에서는 총 17명의 환자 중 15명에서(88%) 부정맥이 종결 되었으나, 지속성 심방세동 환자에서는 부정맥 종결이 관찰되지 않았다. 발작성 심방세동 환자의 87%에서 가장 높은 DF 값을 보이는 위치에 대한 고주파 절제가 부정맥 종결로 이어졌다. 일련의 연구들 역시 마찬가지로 가장 높은 DF 값을 보이는 위치 (DFmax)가 심방세동을 유지시키는 데에 매우 중요한 역할을 담당한 다는 사실을 보여주고 있다[ 141- 143]. 한편 최근의 232명의 심방세동 환자를 포함하여 시행한 무작위 비교 대조 연구에서는 폐정맥 격리술만 시행한 것에 비해 DFmax 위치에 대한 고주파 절제를 함께 수행하였을 시에 추가적인 임상적 우월성을 관찰하지 못하였다[ 144]. 현재로서는 어떠한 연구 집단에서도 DF 에 기반한 접근법을 발작성 심방세동의 표준 치료 지침에 포함시키지 않고 있다. 이러한 기존의 연구에 근거할 때, DF 에 근거한 절제술 전략은 그 효용성에 있어 의문성이 있다고 할 수 있겠다 (Class IIb, LOE C-LD) ( 표 1).
신장신경 차단술
동맥성 고혈압은 심방세동에 동반되는 가장 흔한 질환이며, 또한 동시에 심방세동을 지속시키고 더욱 악화시키는 주요한 원인이다. 동물 연구에서 관찰된 신장신경 차단술의 항부정맥 효과는 이 시술을 통해 심방세동의 지속 및 진행을 억제시킬 수 있을 것이라는 가능성을 강하게 시사한다[ 145, 146]. 실제 심방세동 환자에서 신장신경 차단술의 효과를 연구한 연구에서는 총 27명의 심방세동과 함께 약물로 조절되지 않는 고혈압을 함께 가진 환자를 포함하였고, 총 12개월의 추적관찰 기간 동안에 폐정맥 격리술만 시행한 환자 (69%)에 비해 신장신경 차단술을 함께 시행한 환자 (29%)에서 심방세동이 덜 재발하는 것으로 나타났다. 뿐만 아니라 혈압의 감소 역시 폐정맥 격리술과 신장신경 차단술을 함께 시행받은 환자에서 더 뚜렷한 것으로 보고되었다[ 147]. 최근 80명의 심방세동과 고혈압을 함께 가진 환자를 대상으로 무작위 대조 연구를 수행한 결과 폐정맥 격리술의 이득은 지속성 심방세동 및 약물로 조절되지 않는 고혈압을 가진 환자에서 더욱 뚜렷이 나타나는 경향을 보였다[ 147]. 뿐만 아니라 약물로 조절 되지 않는 심방세동에서 폐정맥 격리술 대신에 신장신경 차단술을 시행한 환자에서 6개월간 심방세동의 재발이 관찰되지 않은 증례 역시 보고된 바 있다[ 148]. 하지만 신장신경 차단술을 폐정맥 격리술과 함께 시행하였을 때에 어떠한 기전을 통하여 심방세동의 재발을 방지하는지에 대해서는 명확히 밝혀지지 않았다. 합리적인 설명의 하나는 고혈압의 조절이 심방세동의 재발을 억제한다는 것이며, 또 다른 가능성은 신장신경 차단술이 교감신경계를 억제함으로써 심방세동의 재발을 막는다는 것이다. 현재로서는 신장신경 차단술을 통한 심방세동의 치료를 지지할 만한 근거는 매우 제한적이며 추후 많은 연구를 필요로 하는 분야이다. 따라서 현재로서는 임상 연구의 범위를 벗어나 치료의 수단으로서 심방세동 환자에서 신장신경 차단술은 권고하지 않는다. 이 권고는 심방세동에서 신장신경 차단술의 긍적적인 효과를 보였던 연구뿐만 아니라 최근에 고혈압의 조절에 있어 신장신경 차단술이 효과적이지 않다는 대규모 무작위 대조 연구인 SIMPLICITY HTN-3 연구 결과를 함께 반영한 것이다[ 149].
심방세동 심외막 절제술
최근 흉강경을 통한 심외막 절제술과 기존의 심내막 고주파 절제술을 병용하여 심방 세동을 치료하는 방법에 대한 많은 연구들이 보고되었다. 이러한 심외막 절제술의 장점은 더욱 안정적인 절제술 위치의 확보, Marshall 인대, 신경절 얼기나 좌심방이와 같은 해부학적 구조에 대한 접근 및 횡격막신경이나 식도 등에 대한 손상 가능성을 최소화 할 수 있다는 것이다. 카테터 절제술이 실패한 심방세동 환자에서 심외막 절제술과 심내막 절제술의 재시도를 비교한 연구들이 보고되었다[ 150- 152]. 이 연구들과 기존의 관찰 연구를 포함하여 수행된 메타분석 결과 심외막 절제술을 수행받은 환자에서 뚜렷한 임상적 우월성이 보고되었고, 이러한 임상적 이득은 지속성 심방세동 환자에서 더욱 뚜렷이 관찰 되었다[ 153]. 부작용은 심외막 절제술 군에서 3배 가량 많았고 이는 주로 기흉과 흉막삼출의 발생으로 인한 것이었다. 다수의 관찰 연구에서 카테터 절제술과 흉강경을 통한 심외막 절제술 기법을 결합한 하이브리드 시술의 장점이 보고된 바 있으나 현재까지 이를 증명할 만한 무작위 대조 연구는 수행된 바가 없다[ 154- 157]. 이러한 접근법이 보다 널리 적용되기 위해서는 각각의 시술법을 더욱 간소화 하는 과정이 필요할 것이다.
심방세동 환자의 임상 경과 호전을 위한 비-절제술 전략
항부정맥제 사용
심방세동의 전기충격을 통한 동율동 전환이 심장 구조의 역재형성화를 촉진하는 것으로 알려져 있다. 이 가설은 동율동 전환 1-4 주 후에 관찰 되는 심방의 APD, ERP, 전도 속도 및 P 파 길이 등의 변화를 통해 확인할 수 있다[ 158- 160]. P 파 길이의 변화는 매우 천천히 발생하고, 동율동의 지속적인 유지를 예측하는 지표로 활용 되지는 않는다[ 159]. 중요한 의문은 과연 고주파 절제술 시행에 앞서 항부정맥제의 투여가 심장 구조의 변형을 억제하고 반대로 역재형성화를 촉진함으로써 절제술의 성공률을 증가시키는가 이다. 항부정맥제가 전기적/구조적 심장의 재형성화를 억제함으로써 심방세동 부담을 줄여주어 시술의 성공률을 증가시켜줄 수 있겠으나, 폐정맥 근처의 전기 전도를 저해하거나 자발성을 억제하고 폐정맥 외의 전기자극을 저해함으로써 시술을 어렵게 만들 수도 있다. 실제 항부정맥제가 시술 시 전기 흐름에 어떠한 영향을 주는 지에 대해서는 정확히 규명된 바가 없다. 무작위 대조연구인 SPECULATE 연구에 따르면 시술 전에 amiodarone 투여를 받은 환자에서 시술 시 심방세동의 종결과 비-폐정맥 트리거의 발견이 적은 것으로 나타났다[ 161]. 6개월 추적 관찰에서는 amiodarone 투여군과 비투여군 간에 차이가 없었으나 12개월 째에는 amiodarone 을 투여하지 않고 시술한 환자군에서 재발이 적었다. 하지만 본 SPECUALTE 연구의 한계로는 amiodarone 을 투여 받은 많은 환자가 동율동 전환이 되지 않은 AF 상태에 있었고 이로 인해 amiodarone 의 장점 중 하나인 역재형성화가 발생할 시간이 없었던 것이다. 임상적 견지에서는 시술 전에 환자들의 증상을 호전 시키기 위해 항부정맥제의 투여가 필요한 경우가 많이 있다. 실제로 이러한 항부정맥제의 투여를 통한 구조적/전기적 재형성화를 호전 및 역전시키는지에 대한 뚜렷한 증거는 희박하다. 항부정맥제의 투여를 통해 동율동 전환이 이루어진 환자에서 긍정적인 임상결과를 보고한 연구 결과가 실제 이러한 재형성화에 의한 것인지, 아니면 동율동전환이 된 환자에서 질병이 덜 진행되었기 때문인지에 대해서도 정확한 결론을 내리기가 힘들다. 또한 amiodarone 의 투여를 통한 심방세동 주기길이의 연장이 시술 시 심방세동 종결의 확률을 늘렸지만, 반대로 심방세동 트리거를 숨김으로써 장기적인 성공률을 낮출 수 있다는 우려가 존재한다. 이러한 근거에 기반할 때 시술 전에 항부정맥제를 중단하여 시술 성공률을 증가 시키고자 하는 시도는 장기적인 예후를 호전 시키는 것에 있어서 근거가 부족하다고 판단한다 (Class IIb, LOE C-LD) ( 표 1). 또한 시술 전후에 있어서 항부정맥 약제를 시작 하거나 중단함으로써 시술 이후 결과를 개선시키고자 하는 시도 역시 그 근거가 부족한 것으로 판단된다 (Class IIb, LOE C-LD) ( 표 1).
위험인자 교정
본 문서의 3장에서는 심방 세동 환자에서 위험 인자 교정을 통한 임상적 경과의 호전에 대해서 다루었다. 기존의 연구에 근거할 때에 심방세동에 대한 절제술을 고려하는 환자에서 몸무게 감량은 위험인자 교정의 관점에서 볼 때 유용한 것으로 판단된다 (Class IIa, LOE B-R) ( 표 1) [ 162- 164]. 또한 수면 무호흡의 증상 및 소견이 있는 환자에서 이에 대한 검사를 진행하는 것을 권고한다 (Class IIa, LOE B-R) [ 165, 166]. 더 나아가 심방세동으로 절제술을 고려하는 환자뿐만 아니라 전체 심방세동 환자에서 수면무호흡을 치료하는 것을 권고한다 (Class IIa, LOE B-R) ( 표 1).
1. 심방세동 절제술을 고려하는 환자를 포함한 전체 심방세동 환자에서 체중 감량은 포괄적인 위험인자 교정의 일환으로 유용할 수 있다. (IIa) 2. 심방세동 절제술을 받는 환자에게 심방세동 절제술의 위험, 이득 및 결과에 관해 논의 할 때 환자의 체질량지수를 고려하는 것이 합리적이다. (IIa) 3. 심방세동 절제술을 위해 환자를 평가할 때 수면 무호흡증의 징후와 증상을 스크리닝하고 수면 무호흡증이 의심되는 경우 수면 평가를 권유하는 것이 합리적이다. (IIa) 4. 수면 무호흡증의 치료는 심방세동 절제술을 고려하는 환자뿐만 아니라 전체 심방세동 환자에서 유용 할 수 있다. (IIa)
비-협부 의존성 심방조동의 기전적 이해와 지도화 및 절제술 전략
심방세동 절제술 이후 심방 조동의 발생은 매우 흔하기에, 심방세동 절제술을 시행하는 의료진은 전형적 및 비전형적 심방조동의 지도화 및 절제술에 능숙해야 할 것이다. 심방세동 절제술 이후 심방조동의 발생 확률을 심방세동 절제술의 시술 방식에 따라 다양하다[ 167- 169]. 심방조동의 발생은 고주파 폐정맥 격리술에 비하여 냉각풍선을 통한 폐정맥 격리술 후에 빈도가 적은 것으로 보고된 바 있다[ 170]. 심방조동의 병태 기전은 전기 회로의 회귀에 의한다. 이러한 회귀성 부정맥은 기존의 폐정맥 격리선 사이로 전기의 흐름이 빠져 나오는 국소적 회귀와 해부학적 장애 구조 (승모판륜, 좌심방 천장, 심방중격)를 통해서 나오는 거대 회귀가 있다[ 31, 64, 171, 172]. 정맥-삼첨판 협부를 통해서 발생하는 전형적인 심방조동 역시 발생 가능하다. 회귀로의 위치에 대한 감별은 12-유도 심전도에 대한 분석에서부터 시작한다. 모든 12유도에서 관찰되는 뚜렷한 등전위선은 작은 회귀로를 시사하는 반면에, 지속적인 활성화는 규모가 큰 전기 회로를 타고 도는 심방조동을 시사한다[ 173]. 전형적인 정맥-삼첨판 협부 의존적 조동은 좌심방 절제술 이후에 12-유도 심전도 상에서 비전형적인 모양을 나타낼 수 있기 때문에, 심전도 모양을 통해 정맥-삼첨판 협부에서 기인하는 전형적인 심방조동의 가능성을 배제해서는 안될 것이다[ 174]. 비록 좌심방 절제술이 심전도 해석을 어렵게 할 수는 있지만, 폐정맥 입구에서 기인하는 심방 세동이 축의 하향 전위와 전흉부 유도에서 양성 F 파를 보인다는 법칙은 여전히 적용된다. 비전형적 심방조동 환자에서 회귀로의 위치 파악은 관상정맥동에 위치한 카테터의 활성화 순서를 분석함으로써 비교적 수월하게 진행할 수 있다. 근위에서 원위로 활성화가 이루어 진다면 정맥-삼첨판 협부에서 기인하는 심방조동, 우측 폐정맥, 반시계 방향의 승모판륜 심방조동을 생각할 수 있고 원위에서 근위로 향하는 관상정맥동 활성화를 보이는 경우 좌측 폐정맥, 시계방향의 승모판륜 심방조동의 가능성이 있다. “On time” 혹은 합쳐진 관상정맥동의 심전도 모양은 좌심방 천장에서 기인하는 조동을 시사할 수 있다. 전기해부학적 활성화 지도를 그린 다음에, 각각의 위치에 대한 세밀한 분석이 시술자에 의해서 이루어 져야 한다. 다지점 지도화는 분석에 걸리는 시간을 줄일 수 있으나, 자동화된 심전도 분석의 사용은 오히려 시술에 혼란을 가중시킬 수 있다. 최근에는 매우 정교해진 자동 분석 시스템 역시 활용이 가능하며[ 175], 이러한 시스템을 적절하게 활용 하면 동조(entrainment) 지도화 없이 활성화 지도화만으로도 절제술을 시행할 수 있다고 일부 연구에서 보고하고 있다. 한편, 실제 이러한 첨단 시스템의 임상적 유용성에 대해서는 의문이 여전히 남아 있기에 대규모 무작위 임상 연구를 통한 규명이 필수적이다. 심방조동에 대한 절제술을 수행할 때에 기존의 흉터 역시 다른 해부학적 장애물과 함께 파악해야 한다. 국소적 작은 전기 회로에 의한 빈맥 역시 발생할 수 있는데 이는 특징적으로 국소적인 초기 발생 위치에서 벗어난 원심형 전도를 특징으로 하며, 빈맥 주기 길이의 50% 이상에 해당하는 길이가 긴 분절 전기신호를 특징으로 한다[ 173]. 이러한 활성화 지도화의 장점은 검사에 의해 부정맥의 종결이 잘 일어나지 않는다는 것이지만, 해석이 극히 어렵고 실제로 성공적인 시술로 이어지지 않는 경우가 많다. 일반적인 삼차원 지도화 기구를 이용하여 비전형 심방조동을 절제할 때, 대부분의 시술자들은 다양한 위치에서 시행한 동조 지도화가 더욱 정확한 정보를 제공한다고 판단하고 이를 표준치료지침으로 여기는 연구자들이 많다. 비전형 심방조동 환자에서 일차적인 목표는 빈맥의 주기 길이와 20 ms 내의 차이를 보이는 박동 후 거리를 나타내는 지점을 찾아내는 것이다. 주의할 점은 고출력의 자극이 자극 부위 주위를 함께 캡쳐하여 해석에 영향을 줄 수 있기 때문에 정확한 캡쳐 임계치 값으로 자극하는 것이다. 또한 고출력 자극은 전극의 극성을 유도하여 복귀 신호의 분석을 방해할 수도 있다. 일단 회귀 전기 회로가 규명되고 나면 해부학적 장애물들을 연결시킴으로써 빈맥을 억제하는 전략을 수립할 수 있다. 이러한 선호도에도 불구하고, 동조 지도화는 시술 시에 조동을 종결 시키거나 심방세동으로 변형시킬 수 있는 한계를 지니기에, 고밀도 자동화 지도화에 대한 지속적인 연구가 이루어지고 있다. 이러한 고밀도 자동화 지도화에 대한 대규모 무작위 임상 연구 역시 필요할 것이다[ 172, 175]. 폐정맥에서 기인하는 빈맥의 경우 폐정맥 격리선 사이에 2개의 간극이 일반적으로 존재하며, 재격리술을 시행하면 일반적으로 빈맥을 종결 시킬 수 있다. 거대 회귀성 빈맥의 경우, 해부학적 장애물과의 연결이 필요하다. 일반적인 폐정맥 격리술 이후 발생하는 거대 회귀성 빈맥은 승모판륜에서 기인하는 심방조동 이며, 승모판륜과 좌측 폐정맥 사이 (승모판 협부) 에 대해 절제술을 시행하는 것이 일반적이지만, 승모판륜과 좌상 폐정맥, 우상 폐정맥 및 심방 천장 사이에 전방선 절제술 역시 고려할 수 있다. 승모판 협부 절제술을 위해서는 80% 경우에 있어 심외막 관상정맥동 절제술이 요구된다. 이러한 선형 절제술의 종결점은 자극 이후에 관찰되는 양방향 차단 소견으로 삼아야 한다. 임상적 빈맥에 대한 종결 이후에, 다시 연결된 폐정맥에 대한 재격리술을 시행해야 한다.
심방세동 절제술 시의 마취
절제술을 시행할 때의 마취 방법의 선택은 마취과의 지원가능여부에 의해 결정된다. 카테터와 지도화 도구의 안정적인 유지를 위해 환자의 움직임을 최소화 하는 것이 필요하기 때문에, 깊은 진정 수면이나 전신 마취가 일반적으로 이루어진다. 한 전향적 무작위 연구에서는 심방세동으로 시술받는 환자는 전신 마취와 의식하 진정으로 무작위 배정하고 관찰할 경과 전신 마취가 시술 성공률을 높이고, 폐정맥의 재연결 및 이로 인한 재시술 필요성을 낮추고 방사선 노출시간 역시 낮추는 것으로 보고하였다[ 176]. 또 다른 비무작위 임상 연구에서는 심방 세동 절제술 시에 고빈도 양압환기의 유용성을 보고한 바 있다[ 177]. 하지만 일부에서는 전신 마취를 할 경우 심방-식도 누공의 확률이 증가하는 것인 것으로 보고되었다[ 178- 180].
폐정맥의 전도 재발 유무에 따른 심방세동 재발
심방세동으로 절제술을 받은 이후에 다시 전기생리검사를 시행하는 환자에 있어 총 80% 정도에서 일정 정도의 폐정맥의 재연결이 관찰된다. 이러한 폐정맥 재연결은 폐정맥 격리술 이후에 양호하게 지내는 환자에서도 흔히 관찰된다. Gap-AF 임상 연구에서는 완전한 폐정맥 격리술을 실시한 환자의 70%와 의도적으로 간격을 두고 폐정맥 격리술을 시행한 환자의 89%에서 시술 이후 폐정맥 재연결이 관찰되었다고 보고하였다[ 40]. 폐정맥 재연결이 관찰된 환자에서는 폐정맥 재격리를 실시하는 것이 권고되고 있다. 이 때에는 전체 폐정맥에 대한 시술 대신에, 재연결이 관찰되는 폐정맥 부위에 대한 시술만으로 해결할 수 있다. 또한 재연결이 관찰되는 폐정맥 주위로 환상형으로 재격리를 실시하는 것도 가능하다. 한편 폐정맥 재연결이 관찰 되지 않는 재발 환자에서는 폐정맥 이외의 부분에 대한 시술이 필요하며, 비-폐정맥 트리거에 대한 규명이 필요하고, 하나 이상의 선형 절제술을 시행하거나, 관상정맥동 분리술, 좌심방이 격리술, 자율신경절 절제술, CFAE 절제술, 회전활동성 절제술 등을 고려할 수 있다. 최근의 보고에 따르면 비-폐정맥 트리거에 의한 심방세동 환자에서, 명확히 규명된 유발 가능한 부위가 보고된 환자에서 시술 성공률이 높았다고 보고되고 있다[ 181].
발작성 및 장기 지속성 심방세동 절제술의 종결 시점
폐정맥 격리술은 심방 세동의 절제술에 있어서 가장 중점이 되는 부분이다. 지속성 심방세동의 절제 시술에 있어서 폐정맥 격리술 외에 다른 종결 지점의 필요성에 대해서는 근거가 불명확하다. 폐정맥 격리술 외에 다른 시술 여부에 상관 없이, 지속성 심방세동의 절제술에 있어서는 심방세동의 종결, 즉 동율동 혹은 규칙적인 심방 빈맥으로 전환을 종결점으로 삼을 것을 권고하고 있다. 일부 연구에서는 심방세동의 종결이 좋은 장기 예후 인자라고 보고한 반면, 또 다른 연구에서는 이러한 가설을 확증하지 못하였다[ 161, 182- 186]. 따라서 시술 중에 관찰되는 심방세동의 종결이 실제로 지속성 심방세동 환자에서 종결 시점인지에 대해서는 근거가 부족하다. STAF AF II 연구에 대한 후속 연구는 이러한 시술 시 심방세동 종결을 시술의 종결점으로 삼는 것에 대해 회의적인 결론을 내렸다. 관상정맥동, 좌심방이 혹은 우심방이에서 관찰 되는 심방세동 주기시간의 연장은 심방세동 환자에서 일관되게 측정하기 힘들다는 한계가 있음에도, 시술 시에 높은 빈도로 심방세동 종결의 예측인자로 사용되었다고 보고하고 있다. 또한 상대적으로 긴 심방세동 주기시간은 심방세동 절제술 시에 종결이 잘 되고 반응이 좋을 것이라는 지표가 될 수 있겠지만 그 자체로 종결점이 되기는 힘들다고 제시하고 있다[ 187]. 장기 지속성 심방세동 환자에서는 비-폐정맥적 접근법이 시도되고 있다. CFAE가 이러한 환자에서 주요한 치료 목표로 제시되고 있지만, 최근 보고된 다수의 무작위 배정 연구와 메타 분석에서는 명확한 임상적 효용성이 관찰되지 않았다[ 188]. 이소프로테레놀 투여를 통해 규명한 비-폐정맥 트리거의 절제술, 심방 흉터부위 및 회전성 활성 전위에 대한 절제술 역시 폐정맥 격리술에 비해 추가적인 효용성이 보고된 바 있다[ 88, 94, 189, 190]. 이 중 어떠한 부위를 치료의 목표로 삼더라도, 추후에 심방빈맥이 재발되는 것을 막으려면 해당 부위에 대한 완벽한 절제술을 시행하는 것을 치료의 목표로 삼아야 한다. 경험적으로 시행되는 선형 절제는 지속성 심방세동에 있어서 뚜렷한 임상적 이득이 없다[ 191, 192]. 한편 폐정맥 격리술에 더해 심방 천장이나 승모판륜에 대한 절제술을 수행 하는 경우에는 양방향 차단을 종결점으로 삼아야 한다. 이러한 시술 선에 대한 차단은 동율동 상태에서 평가 되어야 하며, 감별 조율 기법으로 확인 해야 한다.
표1.
|
권고 |
등급 |
근거수준 |
참고문헌 |
|
카테터 절제술에 의한 폐정맥 격리 |
폐정맥의 전기적 격리는 모든 심방세동 절제술에서 권장된다. |
I |
A |
[13,15,27] |
|
전기적 격리를 달성하려면 최소한 폐정맥에 들어가는 전도 차단을 확인해야 한다. |
I |
B-R |
[29,31,33,38,40] |
|
초기 폐정맥 격리 확인 후 20분 동안 폐정맥 전도 재발을 모니터링 하는 것이 합리적이다. |
IIa |
B-R |
[32,42-44] |
|
폐정맥 전도 재발을 확인하기 위해 폐정맥 격리 20분 경과 후 아데노신을 투여하는 것이 고려될 수 있다. |
IIb |
B-R |
[45-48,50] |
|
절제 라인 상 박동-캡쳐 절제 전략이 고려 될 수 있다. |
IIb |
B-R |
[54-56] |
|
출구 차단의 확인이 고려 될 수 있다. |
IIb |
B-NR |
[58] |
|
폐정맥 격리술에 더하여 고려할 수 있는 추가적인 절제 전략 |
심방세동 절제술 시 전형적인 심방조동이 유발되거나 전형적인 심방조동의 과거력을 가진 환자의 경우, 정맥-삼첨판 협부 부위의 시술을 권고한다. |
I |
B-R |
[60-63] |
|
선형 절제 병변을 시행하는 경우, 라인 완성도를 평가하기 위해 지도화 및 박동 기법을 사용해야 한다. |
I |
C-LD |
[62,70-72] |
|
심방세동 절제술 시 폐정맥 입구 외부에서 반복적으로 심방세동을 유발하는 국소 트리거가 발견되면, 그러한 국소 트리거를 절제하는 것을 고려해야 한다. |
IIa |
C-LD |
[93-95] |
|
접촉력 감지 고주파 절제 카테터를 사용하는 경우 최소 5-10 그람 이상을 유지하는 것이 합당하다. |
IIb |
C-LD |
[37] |
|
발작성, 지속성 및 장기 지속성 심방세동 환자의 첫 시술이나 재시술시에 후벽 분리를 고려할 수 있다. |
IIb |
C-LD |
[81,82] |
|
발작성, 지속성, 장기 지속성 심방세동의 첫 시술 혹은 재시술 시 고용량의 이소프로테레놀을 주입하여 비-폐정맥 트리거를 찾아 절제술을 시도해보는 것을 고려해 볼 수 있다. |
IIb |
C-LD |
[93-95] |
|
심방세동 절제술 시 우세빈도 기반 절제술 전략의 효용성은 잘 알려져 있지 않다. |
IIb |
C-LD |
[144] |
|
지속성 또는 장기 지속성 심방세동의 초기 및 재 절제술 시 우심방이나 좌심방의 선형 절제 병변의 유용성은 잘 확립되어 있지 않다. |
IIb |
B-NR |
[28,73,77] |
|
거대 회귀 심방조동이 없는 경우, 선형 절제 병변의 유용성은 충분히 확립되어 있지 않다. |
IIb |
C-LD |
[28,73,77] |
|
지속성 및 장기 지속성 심방세동의 초기 또는 반복 절제술 전략으로서 전압 지도화 또는 MRI로 식별된 비정상 심근 조직의 절제는 아직 근거가 확립되지 않은 상태이다. |
IIb |
B-R |
[115-117] |
|
지속성 혹은 장기 지속성 심방세동 환자에서 복합 분획 심방 전기도를 겨냥한 전극 도자 절제술을 첫 시술 시, 혹은 재 시술 시 시도하는 것에 대하여, 아직까지 잘 정립되어 있지 않다. |
IIb |
B-R |
[73,75,105,106] |
|
지속성 그리고 장기 지속성 심방세동에 대한 초기 또는 반복 절제술 전략으로서 회전활동성의 절제술의 유용성이 잘 확립되어 있지 않다. |
IIb |
B-NR |
[120,122-124] |
|
발작성, 지속성 및 장기 지속성 심방세동의 처음 또는 반복 절제 전략으로서의 신경절 얼기 절제의 유용성은 아직 잘 확립되어 있지 않다. |
IIb |
B-NR |
[136] |
|
결과를 개선하기위한 비-절제술 전략 |
심방세동 절제술을 고려하는 환자를 포함한 전체 심방세동 환자에서 체중 감량은 포괄적인 위험인자 교정의 일환으로 유용할 수 있다. |
IIa |
B-R |
[162-164] |
|
심방세동 절제술을 받는 환자에게 심방세동 절제술의 위험, 이득 및 결과에 관해 논의할 때 환자의 체질량지수를 고려하는 것이 합리적이다. |
IIa |
B-R |
[162-164] |
|
심방세동 절제술을 위해 환자를 평가할 때 수면 무호흡증의 징후와 증상을 스크리닝하고 수면 무호흡증이 의심되는 경우 수면 평가를 권유하는 것이 합리적이다. |
IIa |
B-R |
[165,166] |
|
수면 무호흡증의 치료는 심방세동 절제술을 고려하는 환자뿐만 아니라 전체 심방세동 환자에서 유용할 수 있다. |
IIa |
B-R |
[165,166] |
|
장기 결과를 향상시키기 위해 시술 전에 항부정맥제를 중단하는 것이 유용한지 여부는 불분명하다. |
IIb |
C-LD |
[158-161] |
|
장기 결과를 향상시키기 위해 시술 전후에 항부정맥 약제를 시작하거나 지속하는 것의 유용성은 불분명하다. |
IIb |
C-LD |
[158-161] |
|
심방세동 절제술 의 위험을 줄이기 위한 전략 |
폐정맥 내에서 절제를 피하기 위해서는 폐정맥 입구를 주의 깊게 식별해야 한다. |
I |
B-NR |
[193] |
|
식도 근처의 후벽을 따라 병변을 만들 때 고주파 에너지를 줄이는 것이 좋다. |
I |
C-LD |
[91,92] |
|
식도 손상 위험을 최소화 하기 위해 온도 감지계를 식도 내부에 위치시켜 열에너지 전달 정도를 모니터링 하는 것이 합리적이다. |
IIa |
C-EO |
[91,92] |
II. 기술 및 도구
이 장에서는 심방 세동 절제술에 사용되는 최신 기술을 소개하려 한다.
고주파 에너지의 사용
고주파는 심방세동 절제 포함 모든 부정맥의 시술에 주로 사용되는 에너지원이다. 냉각풍선 절제는 심방세동 절제를 위해 일반적으로 사용되는 추세이지만 심방조동 절제에는 효과가 뚜렷하지 않다.
고주파 에너지는 조직의 저항을 이용한 가열로 깊은 조직까지 열을 전도한다. 고주파는 절제 카테터 끝과 피부에 붙이는 표면이 넓은 분산형 전극 사이에 단극(Unipolar) 방식으로 전달된다. 분산형 전극의 위치는 병변 크기에 영향이 거의 없다. 만약 고출력 시스템을 사용한다면, 피부 화상 방지를 위해 분산형 전극을 두개 사용하는 것이 좋다. 고주파 이용 시에 병변의 크기 및 깊이를 결정하는 인자는 전력, 임피던스, 온도, 지속 시간 및 접촉력이다[ 1- 3]. 높은 전력과 센 접촉은 병변을 크게 만들 수 있다. 그러나 전극-조직 사이의 온도가 100℃를 초과하면, 혈액이 끓어오르고, 혈액 단백질이 재(char)와 응고물을 형성한다. 응고된 부분이 전극에 붙으면 에너지 전달을 위한 표면적이 적어지고 전류 밀도가 증가하여, 더 많은 조직과 혈액이 가열되어 전기 저항이 빠르게 증가한다[ 3]. 카테터 온도가 100℃를 초과하면, 팽창한 증기가 심근으로 갑자기 분출되고(스팀 팝) 이는 심근 파열 또는 천공을 초래할 수 있다[ 4]. 관류(irrigation)를 이용한 지속적인 냉각 및 높은 전력 전달은 열 전달의 깊이와 병변 크기를 증가시킨다. 심근 전층의 병변 생성을 위해, 혈전과 재(char) 감소를 위해 관류 고주파 카테터가 심방세동 절제에 일반적으로 사용된다[ 5]. 최적의 카테터-조직 접촉을 위해 조종 가능한(steerable) 카테터, 시술자의 기술 및 접촉력 모니터링이 필요하다[ 6]. 만약 고주파 전력이 적절하지 않으면 심방세동 절제술 중에 상당한 합병증이 발생할 수 있다. 다른 부정맥에 비해 심방세동 절제술이 위험한 이유는 절제해야 하는 조직이 많고, 페정맥 및 식도 등 근접한 구조물 때문이다. 심장내 초음파로 카테터 끝의 증기 미세 방울이 관찰된다면, 온도를 조정하거나 관류 카테터를 이용하여 혈전과 재 발생을 감소시킬 수 있다[ 7- 10]. 또한 전극-조직 접촉력을 제한하여 스팀팝을 줄일 수 있다. 고주파 공급 시간은 조직 온도에 영향을 미친다. 병변의 절반 형성을 위해 약 5–15초가 소요되고, 최대 병변은 보통 1분 내에 달성된다. 절제 지속 시간이 길면 가열 조직의 저항으로 생성된 열이 더 깊은 병변을 형성한다.
절제술 이후 심근 병변의 진행
절제술에 의해 형성된 병변은 전형적인 괴사, 출혈 그리고 부종을 보인다. 2일에서 7일 후에는 염증 세포의 침윤이 나타나고, 초기 4 주에는 심근 조직이 육아 조직으로 대체된다[ 11]. 50℃이상에 수 초 이상 노출된 심근은 비가역적인 괴사를 보이고 전기적 성질이 없어진 흉터(scar)가 된다[ 12, 13]. 형성된 병변의 경계에서는, 심근 세포가 비활성 또는 휴면 상태가 되었다가, 이후 정상적 전기 전도가 회복되기도 한다. 이러한 상태에서 아데노신 투여에 의한 과분극 효과로 전도가 재활성화 될 수 있다[ 14]. 반대로, 급성 손상 및 미세 혈관계 손상에 대한 염증에 의해 주변 병변의 손상이 진행되는 경우도 있다[ 15].
접촉력 (contact force) 시스템
접촉력 모니터링 시스템은 고주파 절제술 시 병변 크기의 영향을 주는 접촉력을 확인하며 시술할 수 있다[ 16, 17]. 적절한 접촉이 없으면 병변이 형성되지 않고 과도한 접촉은 심부 조직 가열, 스팀 팝, 천공 그리고 심장 외부 장기의 손상을 초래할 수 있다[ 18, 19]. 실시간 접촉력을 측정하기 위해 두 가지 절제 카테터가 이용 중이다. TactiCath (St. Jude Medical, Inc.)는 카테터 팁에서 미세한 접촉력 변화를 측정하기 위해 3개의 광섬유를 사용한다. ThermoCool SmartTouch (Biosense Webster, Inc.)는 절제 팁 전극과 카테터 샤프트 사이의 작은 스프링을 사용하며, 팁에 작은 자기 송신기가 있고 근위부에 있는 자기 센서가 스프링의 미세한 기울기를 측정한다[ 20, 21]. 두 시스템 모두 고해상도(<1g)를 가지며 힘의 방향까지 표시한다. 접촉력을 예측하기 위해 이전에 사용되었던 카테터 끝 모양, 임피던스 변화 등은 실제 접촉력을 반영하기 어려운 것으로 밝혀졌다[ 4, 18, 20, 22]. 실험연구에서 (1) 일정한 고주파 전력이라면 병변 크기는 접촉력 증가에 따라 증가하고 (2) 스팀 팝과 혈전 발생률은 접촉력 과할 때 늘어나고 (3) 접촉력에 기초하여 고주파 전력(예를 들어, 낮은 접촉력에서 높은 고주파 전력 및 높은 접촉력에서 낮은 고주파 전력)을 조정하는 것은 유사한 병변 크기를 만들 수 있다는 것을 보여주었다[ 16, 18]. 접촉력 카테터를 이용한 심방세동 절제는 폐정맥 고립술 시 좌심방 해부학에 대한 중요한 정보를 제공한다. 좌심방 전벽과 후벽, 우상폐정맥(RSPV)의 후방, 좌상폐정맥(LSPV)의 후방 그리고 좌심방 지붕에서 높은 접촉력이 확인되었다[ 20]. 좌측 폐정맥 앞 쪽과 분지(carina)쪽은 접촉력이 낮은 것으로 확인되었다[ 23, 24]. 낮은 접촉력은 폐정맥 재연결(reconnection)과 연관이 있다[ 24]. 접촉력 카테터는 일정 강도의 힘을 전달하여 임피던스 상승, 심장 천공, 스팀팝 및 혈전 형성을 줄이고, 동시에 효과적인 병변 형성을 위한 피드백을 제공한다[ 20, 25, 26]. 여러 연구에서 폐정맥 고립술 시 접촉력 카테터는 갭, 아데노신 유발 휴면 전도, 투시 시간 및 심방세동 재발을 감소시키는 것으로 나타났다[ 21, 27]. 대규모 전향적, 환자-대조군 연구에서 ThermoCool SmartTouch는 발작성 심방세동 환자(HR 2.24, 95% CI 1.29-3.90, p=0.004)에서 치료 효과를 높였으나 비 발작성 심방세동 환자(HR 0.73, 95% CI 0.41-1.30; p=0.289)에서는 효과를 입증하지 못하였다. ThermoCool SmartTouch의 또 다른 임상 시험은 다기관, 전향적 무작위 임상 시험인 Symptomatic Paroxysmal Atrial Fibrillation (SMART-AF) 이었다[ 21]. 170명의 환자 시술 후 1년 추적 관찰에서 심방세동/심방빈맥/심방조동 자유도는 72.5% 로 일반 카테터보다 높았다[ 28, 29]. 심방 세동 절제를 위한 TactiCath 카테터의 효과 또한 여러 임상 시험에서 평가되었다. TOCCATA 연구는 발작성 심방세동 3명에서 낮은 접촉력은 시술 후 재발과 관련이 있음을 보여주었다[ 25]. EFFICAS I 연구에서는 발작성 심방세동 환자 4명에서 낮은 접촉력이 폐정맥 고립술 3개월 후 갭 발생과 연관 있음을 확인하였다[ 30, 31]. TactiCath 카테터는 일반 카테터에 비해 투시 시간을 줄이고 폐정맥 고립술의 고주파 적용 횟수를 줄이는 것으로 나타났다[ 32, 33]. 결론적으로 심방세동 절제에서 접촉력 모니터링은 효과적인 병변 형성과 폐정맥 절제의 지속성을 향상시킬 수 있다. 접촉력과 고주파 전력 및 시간(예: Force-Power-Time Index)을 결합하는 시스템은 병변 형성을 실시간으로 평가할 수도 있다. 이는 경험이 적은 시술자에게 더 유용할 수 있다. 고주파 카테터로 심방세동 절제 시행 시 5~10g 이상의 접촉력이 권장된다.
냉각풍선 절제술 (Cryoablation)
최근 몇 년간 심방세동 시술에서 냉각풍선 절제는 고주파 절제의 효과적인 대안이 되었다. ( 그림 1A) [ 33, 34, 35]. 냉각 절제 시스템은 기본적으로 4가지 부분으로 구성된다. (1) 냉각풍선의 냉각 분사기(applicator)에 냉매로서 액상 아산화질소를 저장하는 가스 탱크; (2) 조종 가능한 유연한 쉬스(steerable FlexCath sheath); (3) 병변 생성을 위한 냉각풍선 카테터; (4) 실시간 폐정맥 신호를 기록하는 지도화 카테터가 그것이다. 냉매의 냉각을 위해 주울-톰슨 팽창(Joule-Thomson expansion) 효과가 이용된다. 이는 압축한 기체를 좁은 구멍으로 분출시키면 온도가 변하는 현상으로, 냉각풍선 온도를 낮춘다. 온도 감소는 사용하는 에너지에 따라 달라진다. 20°C 이하의 온도는 조직 괴사를 초래할 수 있어 냉각풍선 절제에 이용된다. 다기관 전향적 무작위 연구인 STOP-AF 연구에서 1세대 냉각 폐정맥 고립술은 항부정맥제에 비해 높은 12개월 자유도를 보여주었다. (69.9% vs 7.3%) [ 36]. 최근 2세대 냉각풍선은 1세대의 한계를 극복하였다[ 37]. 풍선의 전체 말단 반으로의 냉각 영역의 확장을 포함하여 더 균일한 원주형 절제를 이루게 된 것이다[ 38- 40]. 2세대는 더 많은 주입 튜브와 포트, 동결 영역을 제공하여 절제를 촉진하고 균일한 냉각 영역을 만들 수 있다. 3세대 카테터는 움직임이 용이해지고 폐정맥 신호를 더 잘 감지하기 위해 원형 지도화 카테터 쪽 팁 길이를 줄였다. ( 그림 1)
그림1.
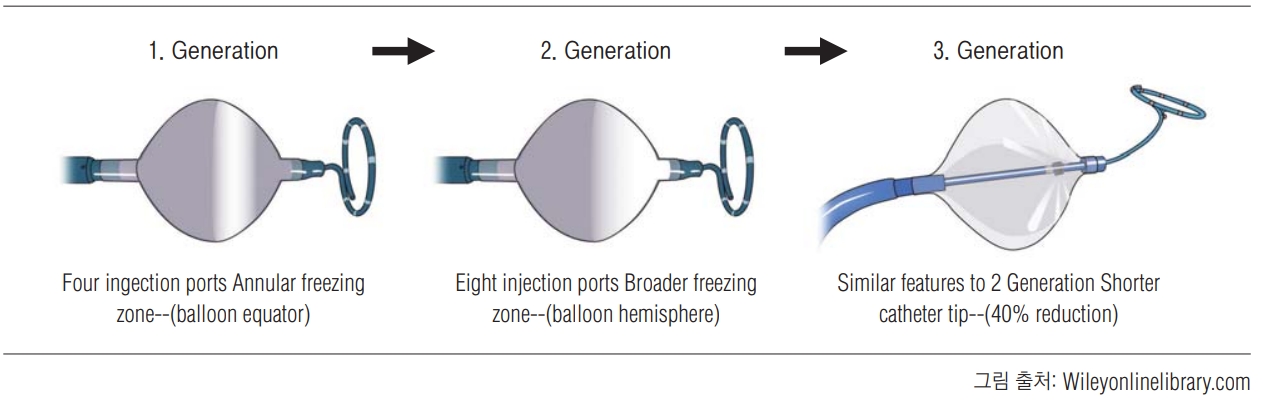
많은 연구에서 발작성 심방세동 환자에서 냉각풍선 절제술이 고주파와 비교하여 비슷한 성공율을 보이고 시술 시간 감소 및 안전성을 보여주었다[ 41- 44]. FIRE AND ICE연구에 따르면 냉각풍선 절제술은 고주파와 비교하여 추적 기간 동안 낮은 재시술 횟수, 낮은 심율동 전환술 횟수, 낮은 재입원을 보이고, 삶의 질은 비슷한 수준으로 향상되었다[ 45]. 냉각풍선 절제술은 시술자가 배우기 쉬운 점도 있다. 냉각풍선 절제술에서 고주파에 비해 많이 발생하는 합병증은 흉곽 신경 손상(phrenic nerve injury)이다. 일시적인 오른쪽 흉곽 신경 손상은 20%의 발생율을 보이며 그 중 영구적인 것은 0-4%로 보고되었다. 냉각풍선 절제에 대한 경험이 쌓이면서 왼쪽 온 폐정맥 (Left common pulmonary vein)에서도 시술가능하며, 지속성 심방세동 환자에서 폐정맥 고립술 때도 고주파 절제술과 효과가 비슷한 것으로 나타나고 있다. 이러한 결과를 토대로 앞으로 사용이 더 증가할 것으로 생각된다.
레이저 풍선 절제 시스템
레이저 풍선 절제 시스템은 중수소 산화물(D2O) 또는 “중수”(heavy water)로 채워진 풍선을 통해 빛 에너지를 전송하여 폐정맥 고립술을 수행한다[ 46- 48]. ( 그림 2) 이 시스템의 특징은 카테터를 통하여 폐정맥 안을 직접 보는 광섬유 내시경을 포함하고 있다는 것이다. 풍선은 폐정맥 크기에 따라 25-32mm의 직경으로 팽창 가능하다. 일단 풍선이 팽창되면 다이오드(diode) 레이저는 폐정맥 안에서 회전하고 눈으로 확인하면서 에너지를 방출한다. 레이저 절제 에너지는 5.5W에서 12W로 조정 가능하며, 부위마다 20-30초 동안 지속될 수 있다. 부위 별로 다른 전력이 사용 가능하다[ 49]. 발작성 심방세동 환자 대상 다기관 시험에서 레이저 풍선의 결과는 고주파 절제와 거의 동일한 것으로 나타났다[ 50]. 횡경막 신경 손상은 레이저(3.5% vs 0.6%; p<0.05)를 사용 시 더 흔했지만 폐정맥 협착은 드물었다(0.0% vs 2.9%; p<0.03) [ 49, 51]. 병변은 심방 벽과 접촉 없이 생성되며, 조직 두께에 따라 보정된다. 비 심장 구조물의 손상 위험을 줄이면서 출력은 절제 경로를 따라 변화하여 전벽 절제를 얻는다.
그림2.
눈으로 보면서 절제 가능한 레이저 풍선 절제 시스템 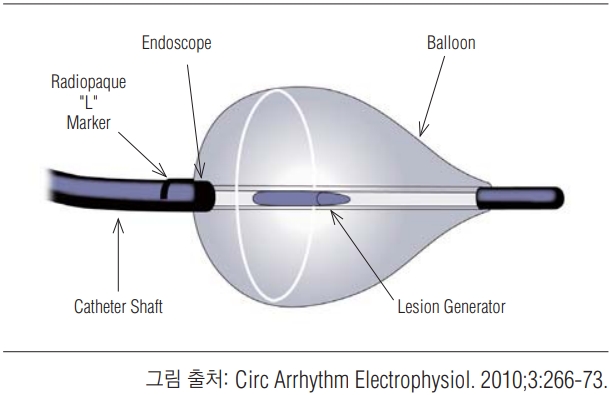
다전극 원주 절제 카테터들
현재 PVAC (The PV ablation catheter)와 nMARQ 시스템 ( 그림 3), 2개의 다전극 원주 카테터 시스템이 소개되어 있다. nMARQ 카테터는 10극의 고주파 절제술 및 지도화 시스템을 결합한 것이다[ 52- 54]. 원형 디자인의 카테터는 사이 간격이 4mm인 10개의 백금 코팅 된 3mm 전극으로 구성된다. 고주파 절제는 관류 가능한 10개의 전극을 통해 동시에 수행할 수 있다. 다기관 등록 연구에서 nMARQ로 절제술의 효과는 다른 절제술과 비슷하였다[ 55]. nMARQ는 여러 전향적 임상 시험이 진행 중이다[ 56]. PVAC은 10개의 백금-이리듐 전극을 이용하여 고주파 에너지를 전달한다. 최초의 단일 기관 연구에서 효과를 보였지만, 다른 연구에서는 무증상의 뇌혈관 색전증이 냉각풍선 절제술과 비교하여 높은 빈도로 나타났다[ 57- 59]. 그 다음 시행된 ERASE 연구(The Endovascular Revascularization and Supervised Exercise Therapy in Patients with Peripheral Artery Disease and Intermittent Claudication)에서 카테터 디자인을 수정하여 무증상 뇌색전증을 감소시켰다[ 56, 59, 60]. 재설계된 PVAC은 냉각풍선 또는 고주파 절제술과 유사한 안전성을 보여주고 있어, 전향적인 무작위 연구가 필요하다.
그림3.
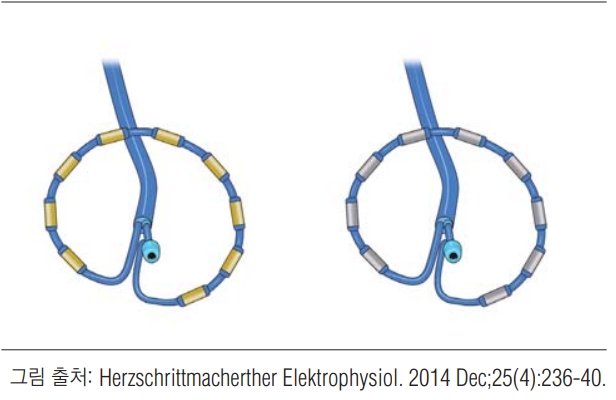
전기 해부학적 지도화 (Electroanatomical mapping)
지도화를 통해 해부학 및 전기 정보를 결합할 수 있으며, 심장 구조의 3D 쉘을 이용한 해부학적 재구성이 가능하다. CARTO 시스템 (CARTO 3, Biosense Webster)은 카테터의 위치 파악을 위해, 자석 기반 또는 전기 임피던스 기반 시스템을, CARTO sound는 심장내 초음파를 이용한다. EnSite NavX (Velocity, St. Jude Medical)은 전압 및 임피던스를 사용하고 최근에는 자석 기반이 결합된 시스템(Ensite precision)도 이용된다. 이는 개방화되어 다른 회사의 카테터도 연결 가능한 장점이 있다. 조종 가능한 전용[ 64]전극 미니 바스켓 카테터를 사용하여 자동화 고밀도 지도화를 사용하는 Rhythmia (Boston Scientific) 시스템도 있다[ 61- 63]. 이 시스템은 복잡한 좌측 심방 조동의 지도화에 유용하다[ 61]. 이러한 지도화는 정확한 카테터 추적을 가능하게 하고 투시 시간을 줄인다[ 64- 66]. 전기 해부학적 지도화의 임상적 유용성에 대한 연구에서는 모순된 결과가 나왔다[ 67- 69]. 그러나 비용 증가에도 불구하고, 편리성 때문에 거의 대부분의 고주파 심방세동 절제에 3D 지도화가 사용된다.
원격 조종 시스템(Robotic and Magnetic Catheter Navigation)
원격 조종 카테터는 방사선 노출과 납 보호복의 사용에 따른 시술자의 건강 위험을 줄일 수 있다. 또한 심전도 및 3D 이미지 분석을 용이하게 한다. 이를 위해 개발된 4 가지 기술이 있다. 1) Stereotaxis에서 설계한 자기 네비게이션 시스템; 2) 카테터 유도, 제어 및 영상 (CGCI) 시스템으로 불리는 제 2자성 시스템; 3) Hansen Medical이 제조한 제 3의 로봇-제어 카테터 시스템; 4) Catheter Robotics에서 개발한 원격 카테터 시스템이 그것이다[ 70- 72]. 이 기술은 심방세동시술에 효과적이며 투시 시간과 방사선 피폭을 현저하게 감소시킨다[ 70- 73].
심장 내 초음파 (Intracardiac echocardiography)
전기 생리학 시술에서 초음파는 유용한 도구이며 혈관 내 접근과 시술 중에 사용된다[ 74, 75]. 실시간 초음파는 비만 환자 또는 경험이 적은 시술자의 경우 및 항응고 요법을 받는 환자에서 더 유용하다. 심장 내 초음파는 전기 생리학 검사와 심방세동 절제에 도움이 된다[ 76- 78]. 심장 내 초음파 사용은 (1) 폐정맥과 식도를 포함한, 해부학 구조를 확인을 도울 수 있고 (2) 사이막 경유를 안전하고 자유롭게 하고 (3) 다전극 원형 절제 카테터 또는 풍선 절제 시스템의 정확한 배치를 도와주고 (4) 적절한 에너지를 적정 부위에 전달하고 (5) 카테터 접촉에 대한 피드백을 제공하고 (6) 혈전 형성을 감지하고 (7) 심장 천공 또는 심낭 삼출의 조기 인식을 가능하게 한다[ 78, 79].
좌심방 자기공명영상
심방세동 환자의 심방 자기공명영상에서 만기 가돌리늄 증강(Late Gadolinium Enhancement) 으로 표현된 심방 섬유화는 절제술 결과와 관련이 있다[ 80- 82]. 그러나 심방 섬유화의 고해상도 이미징은 기술적으로 쉽지 않고 재현성이 떨어진다[ 83]. 자기공명영상은 섬유화를 확인하기 위해 심방세동 카테터 절제술 전에 수행하거나 고주파 절제 병변을 확인하기 위해 절제 후에 수행할 수 있다[ 80, 84, 85]. 섬유화의 정도는 절제술의 결과를 예측할 수 있다[ 86]. DECAAF 연구에서 절제술 전 심방 섬유화의 정도를 1단계 (<10%), 2 단계 (10-20%), 3단계 (20-30%), 4단계(>30%)로 분류하였다. 1년 후 심방세동의 재발은 독립적으로 심방 섬유화와 관련이 있었다(1단계=15 %, 2단계=33 %, 3단계=46 %, 4단계=51 %). 이러한 결과는 섬유화의 정도가 재발을 예측하고 환자 선별에, 즉 어떠한 환자에서 절제술을 시행해야 할지 결정하는데 유용할 수 있음을 시사한다. 만기 가돌리늄 증강이 심방 조직에서 고주파, 냉각풍선 절제 또는 레이저 절제로 카테터 절제술로 유발된 흉터 병변을 가시화할 수 있는지 또는 폐정맥 재연결 부위를 평가한 연구도 있다[ 84, 87]. 최근에는 실시간 자기공명영상 유도 전기 생리학 검사를 허용하는 기술이 개발되었다. 이 방법의 장점은 방사선을 사용하지 않고 병변 발생을 실시간으로 모니터한다는 것이다. 이 시스템은 아직 개발 중이지만 향후 중요한 절제 전략이 될 가능성이 있다[ 88- 90].
III. 안정성을 극대화시키기 위한 도자절제술의 기술적인 측면과 항응고요법
심방세동 전극도자절제술 시술 중 또는 시술 후 혈전색전증의 예방
심방세동 환자는 시술 중, 시술 직후, 그리고 수일에서 수개월간 혈전색전증의 위험이 증가한다[ 1, 2]. 무증상의 뇌색전증 병변이 심방세동 전극도자절제술 후 관찰된다. 시술 전 저위험군이었던 환자에서도 시술 후 일시적으로 혈전의 위험성이 증가한다[ 3]. 혈전색전증을 예방하기 위해 시술 전, 시술 중, 그리고 시술 후 항응고요법에 대한 세심한 주의가 필요하다. 항응고요법에 관한 권고사항이 표 2에 정리되어 있다. 시술로 인해 손상받은 좌심방의 내피세포가 혈전형성을 유발할 수 있다. 경중격 천자를 통해 좌심방 내에 쉬스(sheath)를 위치시키고 카테터를 삽입하는 것이 시술 중 카테터 또는 쉬스의 표면, 쉬스 내에 혈전형성을 촉발할 수 있다[ 4, 5]. 심방조직은 시술 후 수주에서 수개월간 기절상태(stunned)여서 정상적인 수축이 안될 수 있다[ 6]. 항응고요법은 반대로 혈심낭, 심낭압전, 혈관합병증 같은 가장 흔한 합병증과 연관이 있다[ 7]. 따라서, 시술 과정을 통해서 이상적으로 안전한 수준을 유지하도록 주의를 기울여야 한다.
시술 전 좌심방이 혈전의 스크리닝
경식도초음파
시술 후 혈전색전증에 의한 뇌졸중은 매우 중대한 합병증이다. 기존에 존재하던 혈전이 떨어져 나와 발생하는 것이 한가지 기전인데 이것은 경식도초음파로 발견할 수 있다. 시술 중 혈전색전증의 발생 위험도는 심방세동의 종류, 시술 당일 심방세동의 존재 및 지속시간, 좌심방의 크기 및 CHA 2DS 2-VASc 점수 같은 환자의 뇌졸중 위험도 등의 여러 가지 인자에 의해 영향을 받는다. 경식도초음파는 좌심방이를 다양한 단면에서 관찰할 수 있고 심낭삼출, 심기능, 심방중격결손이나 난원공개존증, 또는 이전 시술로 인한 심방중격의 섬유화 등의 추가적인 정보를 통해 시술에 도움을 줄 수 있다[ 8, 9]. 추가적으로, 왼쪽 폐정맥과 능선의 관계, 폐정맥 협착 또는 폐쇄, 삼방심 (cor triatriatum) 과 같은 좌심방의 해부학적인 특성을 파악하는데도 도움이 된다. 많은 기관에서 항응고제를 중단하지 않고 시술을 시행하기 때문에 경식도초음파가 필요 없다고 주장할 수도 있다. 하지만, 항응고제 치료를 적절히 받고 있는 환자들을 대상으로 좌심방 혈전의 발생을 조사한 경식도초음파 연구에서는 1.6%에서 2.1%의 환자에서 좌심방이에 혈전이나 침착물이 존재한다고 보고하였다[ 10]. 일부 연구에서 혈전이 발견될 가능성은 CHA 2DS 2-VASc 점수와 연관이 있었다[ 11]. 다른 위험인자는 좌심방 크기와 지속성 심방세동이다. CHA 2DS 2-VASc 점수가 0점인 경우 혈전은 0.3%미만에서 발견되는 반면 2점이상인 경우 5% 이상에서 발견된다. 좌심방이나 좌심방 내의 혈전을 시술 전에 발견하기 위하여 경식도초음파를 모든 환자에서 할지 선택된 환자에서만 할지는 임상경과에 대한 데이터가 부족하여 시술자에 따라 매우 다양한 상태이다[ 10, 12]. 시술 전후 항응고요법은 심방세동 시술에서 빠르게 변화되고 있는 분야로 최근 RE-CIRCUIT (Randomized Evaluation of Dabigatran Etexilate Compared to Warfarin in Pulmonary Vein Ablation: Assessment of an Uninterrupted Periprocedural Anticoagulation Strategy) 연구가 발표되었는데 비중단 다비가트란이 비중단 와파린보다 주요출혈이 적었다[ 13]. 표 2는 시술 전, 후 항응고요법과 관련된 권고사항을 정리한 것이다. 전기적 율동전환술에서와 같이 시술 전 좌심방이에서 혈전이 발견되었을 경우 시술을 시행해서는 안된다.
표2.
항응고요법 전략: 심방세동 카테터 절제 시술 전, 시술 중, 시술 후
|
권고 |
등급 |
근거수준 |
참고문헌 |
|
시술 전 |
심방세동 카테터 절제술을 받는 환자 중 와파린 또는 다비가트란으로 항응고 치료를 받은 환자에게는 와파린 또는 다비가트란을 중단하지 않고 시술을 시행하는 것이 권고된다. |
I |
A |
[13,67,68] |
|
심방세동 카테터 절제술을 받는 환자 중 리바록사반으로 항응고 치료를 받은 환자에게는 리바록사반을 중단하지 않고 시술을 시행하는 것이 권고된다. |
I |
B-R |
[25] |
|
심방세동 시술 시 다비가트란 또는 리바록사반 이외의 NOAC으로 항응고 치료를 받은 환자의 경우 NOAC 투여를 중단하지 않고 시술을 시행하는 것이 합리적이다. |
IIa |
B-NR |
[24] |
|
심방세동의 심장율동전환과 관련된 항응고 지침은 심방세동 카테터 절제술을 받는 환자에서도 준수되어야 한다. |
I |
B-NR |
[69,70] |
|
심방세동 시술 전에 NOAC으로 항응고 치료를 받은 환자의 경우, 절제술 시행 전에 NOAC을 1-2 회 중단하고 시술 후 재개하는 것도 합리적일 수 있다. |
IIa |
B-NR |
[22,29,71] |
|
심방세동 카테터 절제술을 계획하며 3주 이상 항응고 치료를 받은 환자에서 경식도초음파를 시행하는 것은 합리적이다. |
IIa |
C-EO |
[69,70] |
|
동율동 상태에서 절제술을 시행하고 카테터 절제술 시행 전에 항응고 치료를 받지 않은 환자에서 경식도초음파를 시행하는 것은 합리적이다. |
IIa |
C-EO |
[69,70] |
|
경식도초음파를 시행할 수 없는 환자의 경우 좌심방 혈전을 진단하기 위해 심장 내 초음파 사용을 고려할 수 있다. |
IIb |
C-EO |
[4,18] |
|
시술 중 |
심방세동 카테터 절제술 시 중격천자 전 또는 직후에 헤파린을 투여하고 시술 동안 ACT를 300 이상으로 맞추는 것이 권장된다. |
I |
B-NR |
[4,17] |
|
헤파린 효과를 역전시키기 위해 심방세동 카테터 절제술 후 프로타민을 투여할 수 있다. |
IIa |
B-NR |
[72] |
|
시술 후 |
심방세동 카테터 절제술 전에 항응고제를 투여하지 않고 시술 후 와파린을 사용하는 환자에서, 시술 후 와파린 항응고치료를 시작하기에 앞서 저 분자량 헤파린 또는 정맥 내 헤파린을 사용해야 한다. |
I |
C-EO |
|
|
와파린 또는 NOAC을 이용한 항응고 요법은 심방세동 시술 후 2개월 이상 유지하는 것이 좋다. |
I |
C-EO |
[73,74] |
|
심방세동 시술의 성공여부와 관계 없이 항응고요법은 가이드라인에 따라 시행하는 것이 권장된다. |
I |
C-EO |
[69,70] |
|
시술 2개월 후의 항응고요법은 시술의 성공여부가 아니라 환자의 뇌졸중 위험도에 따라 결정해야 한다. |
I |
C-EO |
[69,70] |
|
심방세동 카테터 절제술 전에 항응고제를 투여하지 않았거나 절제술 전에 NOAC 또는 와파린을 중단했던 환자의 경우 지혈완료 후 3-5시간 후에 NOAC을 재투여할 것을 권고한다. |
IIa |
C-EO |
[22,29,71] |
|
환자의 선호도에 따라 항응고요법의 중단을 고려하는 경우에는 심방세동의 재발을 스크리닝하기 위해 홀터나 심전도 검사를 자주 시행할 것을 고려해야 한다. |
IIb |
C-EO |
|
CT 혈관조영술
CT가 심방세동 시술 전에 혈전을 찾아내는데 유용하다는 연구결과들이 나오고 있다. 경식도초음파를 표준방법으로 하여 몇몇 연구들에서 CT가 좌심방이의 혈전을 진단하는데 높은 정확도를 보임을 보고하였다[ 14, 15]. 지연 영상기법을 사용한 연구들의 메타분석에서는 좌심방이 혈전을 찾아내는 진단의 정확도가 99%라고 하였다[ 16]. 이러한 연구결과들은 심장 CT가 좌심방 혈전을 찾아내는데 유용한 방법임을 시사한다. 하지만 많은 기관에서 시술을 시행하기 수일에서 수주일 전에 CT를 시행하기 때문에 혈전을 찾아내는 목적으로는 사용할 수 없는 경우가 있다. CT 영상 장비와 프로토콜이 기관마다 다양하다는 것도 문제이다. 따라서 아직까지는 CT가 경식도초음파를 대체하여 널리 사용되기에는 데이터가 부족하다고 생각된다. CT가 경식도초음파를 대체하기 위해서는 더 큰 규모의 연구가 필요하다.
심장 내 초음파 (Intracardiac Echocardiography, ICE)
ICE가 시술 전 좌심방이 혈전의 진단에 유용하다는 데이터가 나오고 있다. 폐동맥에서 영상을 잡는 것이 좋다. ICE-CHIP 연구에서 우심방에서 영상을 잡는 것은 경식도초음파에 비하여 민감도가 떨어지는 반면, 폐동맥에서 보는 경우 안전하고 효과적으로 좌심방이를 평가할 수 있는 것으로 나타났다[ 17, 18]. 최근에 시행된 경식도초음파가 음성이거나 애매한 경우 ICE가 좌심방과 좌심방이를 재평가하는데 상호보완적으로 사용할 수 있는 것으로 보고되었다[ 19]. 이러한 결과들은 ICE가 좌심방 혈전을 진단하는데 유용함을 시사한다. 하지만, 아직까지는 ICE가 경식도초음파를 대체하여 널리 사용되기에는 데이터가 부족하다고 생각된다. ICE는 시술자의 숙련도에 따라 결과가 좌우된다는 것도 한계점 중 하나이다. 경식도초음파를 대체하기 위해서는 더 큰 규모의 연구가 필요하다.
항응고요법
시술 전 전신적 항응고요법
많은 환자들이 심방세동 시술 전 CHA 2DS 2-VASc 점수 등으로 평가한 뇌졸중 위험도에 따라 와파린 또는 직접 트롬빈 억제제 또는 Xa 인자 억제제로 항응고요법을 받고 있다. 대부분의 시술자는 CHA 2DS 2-VASc 점수가 2점 이상이고 특히 시술 시에 심방세동 상태일 것으로 예상되는 경우 적어도 시술 3주 이전에 항응고제를 시작한다. 와파린은 약효과가 늦게 나타나고 늦게 없어지기 때문에 시술 전후에 헤파린 또는 저용량 헤파린을 이용하여 “가교”를 해왔다. 이러한 방법은 출혈성 합병증 (특히, 혈관천자부위)이 더 많다는 것이 알려지면서 와파린을 중단하지 않고 진행하는 것으로 바뀌었고 이는 INR이 치료 범위 내에 있다면 더 안전한 것으로 나타났다[ 20, 21]. 다비가트란과 Xa 인자 억제제 (아픽사반, 리바록사반, 에독사반)는 효과가 빠른 시간 안에 나타나고 반감기가 짧으며, 와파린과 비교하여 용량 반응의 예측이 용이하다. 축적된 데이터와 몇몇의 메타연구에서 다비가트란과 Xa 인자 억제제가 심방세동 시술 시에 와파린과 비교하여 비슷한 효율성과 안전성을 보여주고 있다[ 22- 24]. 전향적 무작위 연구인 RE-CIRCUIT이 최근 발표되었는데 104개 기관에서 704명을 무작위 배정하여 와파린을 중단하지 않고 시술을 진행하는 군과 다비가트란을 중단하지 않고 진행하는 군을 비교하였다[ 13]. 시술을 받은 635명의 환자들을 8주간 추적관찰 하였을 때 주요 출혈의 발생률은 다비가트란 군에서 유의하게 적었다. (5명 [1.6%] 대 22명 [6.9%]; 절대 위험도차 5.3%, 상대위험도 감소 77%.) 와파린 군에서는 6명의 심낭압전이 있었으며 다비가트란군에서는 1명이 있었다. 와파린군에서 한 명의 일과성허혈발작이 있었던 반면 다비가트란군에서는 뇌졸중 또는 혈전색전증 없었다. 다비가트란군에서 역전제인 idarucizumab이 필요한 경우는 없었다. 비중단 리바록사반과 비중단 와파린을 비교한 작은 규모의 연구가 있었다(Venture-AF, n=248) [ 25]. 이 연구는 와파린군에서 한 명의 주요 출혈, 한명의 허혈성 뇌졸중, 한명의 혈관성 사망이 발생하였다. 아픽사반을 이용한 비슷한 연구가 최근 발표되었는데 출혈과 혈전색전증의 발생이 와파린과 비교하여 유사한 결과를 보였다[ 26]. 이러한 연구들에 근거할 때 항응고제를 중단하지 않고 시술을 시행하는 것이 안전하면서도 혈전색전증의 위험을 최소화할 수 있는 방법으로 보인다. 항응고제를 중단하지 않고 시술을 시행하는 경우 뇌졸중의 고위험군이고 시술 당시 심방세동 상태에도 경식도초음파를 생략할 수 있을 지에 대해서는 더 많은 연구가 필요하다. 심각한 출혈성 합병증의 치료에 있어서 역전제의 사용 결과에 대한 데이터도 더 필요하다. 표 2에 시술 전, 시술 중, 시술 후 와파린과 NOAC을 사용한 항응고요법에 대한 권고사항이 정리되어 있다.
1. 심방세동 카테터 절제술을 받는 환자 중 와파린 또는 다비가트란으로 항응고 치료를 받은 환자에게는 와파린 또는 다비가트란을 중단하지 않고 시술을 시행하는 것이 권고된다. (I) 2. 심방세동 카테터 절제술을 받는 환자 중 리바록사반으로 항응고 치료를 받은 환자에게는 리바록사반을 중단하지 않고 시술을 시행하는 것이 권고된다. (I) 3. 심방세동 시술 시 다비가트란 또는 리바록사반 이외의 NOAC으로 항응고 치료를 받은 환자의 경우 NOAC 투여를 중단하지 않고 시술을 시행하는 것이 합리적이다. (IIa) 4. 심방세동의 심장율동전환과 관련된 항응고 지침은 심방세동 카테터 절제술을 받는 환자에서도 준수되어야 한다. (I) 5. 심방세동 시술 전에 NOAC으로 항응고 치료를 받은 환자의 경우, 절제술 시행 전에 NOAC을 1-2 회 중단하고 시술 후 재개하는 것도 합리적일 수 있다. (IIa) 6. 심방세동 카테터 절제술을 계획하며 3주 이상 항응고 치료를 받은 환자에서 경식도초음파를 시행하는 것은 합리적이다. (IIa) 7. 동율동 상태에서 절제술을 시행하고 카테터 절제술 시행 전에 항응고 치료를 받지 않은 환자에서 경식도초음파를 시행하는 것은 합리적이다. (IIa) 8. 경식도초음파를 시행할 수 없는 환자의 경우 좌심방 혈전을 진단하기 위해 심장 내 초음파 사용을 고려할 수 있다. (IIb)
시술 중 항응고요법
시술 중 헤파린을 사용하여 적절한 항응고요법을 하는 것이 매우 중요하다. 중격천자 전 또는 직후에 헤파린을 투여하고 시술 동안 ACT (activated clotting time)를 300 이상으로 맞추는 것이 권장된다. 중격천자 직후에 카테터 쉬스나 카테터에서 혈전이 생기는 것이 관찰되기 때문에 조기에 헤파린을 사용하는 것이 위험성을 줄일 수 있다. 7,000명 이상을 대상으로 한 최근의 메타분석에서 ACT를 300이상으로 유지하면서 시술을 하는 것이 출혈위험은 증가시키지 않으면서 혈전색전증의 위험을 낮추는 것으로 나타나 이러한 권고사항을 뒷받침하고 있다[ 27]. 헤파린은 부하용량을 초기에 투여하고 이후에 유지용량을 주입한다. ACT가 목표치에 도달할 때까지 10-15분 간격으로 검사하고 이후에는 15-30분 간격으로 검사한다. 비타민 K 길항제를 복용하고 있는 환자들은 NOAC에 비하여 더 적은 용량의 헤파린으로 더 빨리 목표치에 도달한다[ 28]. 따라서 NOAC을 사용하는 환자는 ACT 검사를 더 자주하고 고용량의 헤파린을 투여해야 한다[ 29]. 와파린을 복용하고 있던 환자는 kg당 50단위를 주사하고 항응고제를 복용하고 있지 않던 환자는 kg당 75단위를, 그리고 NOAC을 복용하다가 한번 또는 두번의 복용을 중단한 경우에는 kg당 120단위을 주사한다. 헤파린 용량은 시술 중 ACT를 300-350초로 유지하도록 조절해야 한다. 혈전의 생성을 막기 위해 헤파린을 섞은 식염수를 카테터 쉬스로 지속적으로 주입해야 한다. 전신색전증을 줄이기 위해 카테터가 좌심방 안에 들어가면 카테터 쉬스는 우심방으로 빼 놓는 것이 도움이 될 수 있다. 헤파린 주입은 모든 카테터가 좌심방에서 나오면 중단하고 카테터 쉬스는 ACT가 200-250초 이하가 되면 제거한다. 카테터 쉬스는 8자 봉합을 통해 항응고요법을 지속하는 상태에서도 제거할 수 있다[ 30]. 아니면 헤파린 효과를 프로타민을 이용하여 역전시킬 수도 있다. 출혈이 지속되거나 심낭압전이 생긴 경우에는 헤파린 효과를 역전시키기 위해 프로타민을 투여해야 한다. 출혈이 멎으면 경구 항응고제의 역전은 권장되지 않는데 이는 시술 후 혈전색전증의 발생을 예방하기 위해서이다. 그러나, 위의 방법으로도 출혈이 지속되는 경우 동결신선혈장을 와파린 효과를 역전시키기 위해 투여할 수 있다. 다비가트란은 idarucizumab으로 역전시킬 수 있다[ 31]. Xa 인자 억제제의 역전제는 현재 개발 중이나 아직까지 임상에서 사용할 수는 없다. 여러한 역전제가 사용가능해질 때까지는 porothrombin complex concentrates (PCC: Factor II, VII, IX, and X) 또는 recombinant activated factor VII (rFVIIa) 를 투여할 것이 권장된다[ 32]. 응고인자 IIa와 Xa 억제제에 대한 역전제가 모두 사용가능해지면 심방세동 시술 중 항응고제를 지속적으로 사용하는 것이 더욱 많아질 것으로 예상된다.
시술 중 항응고요법
심방세동 시술을 통해서 심방세동을 제거하거나 줄였을 때 뇌졸중예방 효과가 있는지에 대해서는 아직까지 확실한 답변이 없는 상태이다. 잘 설계된 임상연구에 의해 이 질문에 대한 답이 나올 때까지는 시술의 성공여부와 관계없이 항응고요법은 가이드라인에 따라 시행하는 것이 권장된다. 환자의 선호도에 따라 항응고요법의 중단을 고려하는 경우에는 심방세동의 재발을 스크리닝하기 위해 홀터나 심전도 검사를 자주 시행할 것을 고려해야 한다. 이러한 권고사항은 다음과 같은 사항에 바탕을 두고 있다: (1) 심방세동의 재발은 시술 후 초기뿐만 아니라 나중에도 흔하다. (2) 무증상의 심방세동이 흔하고 특히 시술 후에는 시술 전보다 더 많아진다. (3) 심방세동 시술은 심방의 일부분을 파괴하는 것이고 이것이 뇌졸중 위험도에 미치는 영향에 대해서는 아직 확실치 않다. (4) 이러한 환자군에서 항응고제를 중단하는 것의 안전성에 대해서 큰 규모의 무작위 전향적 연구가 발표된 적이 없다. (5) 여러 연구들에서 뇌졸중은 시기적으로 심방세동의 발생과 일치하지 않는 경우가 많은 것으로 나타났다. (6) 다비가트란, 리바록사반, 아픽사반, 에독사반 같은 직접 트롬빈 억제제나 Xa 인자 억제제는 와파린에 비하여 사용하기가 더 편리하다. 한편, 시술 후 항응고제를 중단하는 것을 지지하는 경우는 다음과 같은 이유가 있다: (1) 항응고제를 유지하는 경우 출혈의 위험성에 노출되며 삶의 질이 저하된다. (2) 몇몇 대규모 연구에서 심방세동 시술을 받은 환자들은 대조군에 비해 뇌졸중 발생률이 낮았다[ 33]. (3) 시술 후 맥박 확인이나 심전도를 통해 심방세동 재발을 스크리닝하는 경우 뇌졸중 위험이 감소한다는 연구결과가 있다[ 34, 35]. 다수의 뇌졸중 위험인자를 가지고 있는 일부 환자에서는 위험성이 있더라도 전신적 항응고요법을 중단하기를 원하는 경우가 있다. 이러한 환자들에서는 무증상의 심방세동을 찾아내기 위해 지속적인 심전도 검사가 규칙적인 간격으로 시행되어야 한다. CABANA 연구와 EAST 연구가 이 문제에 대한 해답을 제시해 줄 것으로 생각된다. 저위험군 또는 중등도 위험군에서는 현재 가이드라인에서 반드시 항응고제를 복용하도록 권고하고 있지 않기 때문에 다양한 선택이 가능하다. 또 한가지 고려사항은 환자의 선호도가 이러한 결정에 중요한 역할을 한다는 것이다. 환자들에게 현재까지의 권고사항과 연구결과에 대하여 충분히 설명 후 항응고제를 복용하는 것에 대한 이득과 위험도를 고려해 보도록 하는 것이 중요하다. 어떤 환자는 위험도가 높더라도 항응고제의 중단을 강력히 원해서 뇌졸중의 위험을 감수할 수도 있다. 이러한 경우에는 적어도 하루에 두 번 이상 맥박을 확인하도록 하고 규칙적인 간격으로 지속성 심전도 검사를 하게 하여 무증상 심방세동을 찾는 노력을 게을리 하면 안된다. 또 한가지 중요한 점은 심방세동 환자의 뇌졸중은 전부 심장색전증에 의한 것은 아니라는 것이다. 역설적 색전증, 대동맥궁의 동맥경화반 등 다른 원인도 고려해야 한다. 현재까지의 데이터를 검토해 보면 다음과 같다. 다수의 무작위 연구에서 심방세동 시술은 항부정맥제에 비하여 재발을 줄이는데 우월하지만[ 36] 뇌졸중 예방효과가 더 우월한지는 불분명하다. 심방세동 시술이 장기간의 뇌졸중 위험을 감소시키는가에 대한 메타분석에서 13개의 무작위 연구에서 시술을 받은 1,097명과 약제를 복용한 855명을 비교하였다. 시술군에서 7명 (0.64%)의 뇌졸중 또는 일과성허혈발작이 나타났고 약제군에서 2명 (0.23%)에서 나타나서 양군간에 차이가 없었다. 현재까지 심방세동 시술이 장기간의 항응고요법을 중단하게 할 수 하는지에 대한 대규모 무작위 연구는 없었고 대규모의 등록연구와 관찰연구에서만이 주제를 다루었다. 한 연구에서 성공적인 시술 후 항응고제 중단의 장기결과에 대하여 발표하였다[ 37]. 327명의 환자에서 심방세동 종류와 기저 CHA 2DS 2-VASc 점수와 관계없이 항응고제와 항부정맥제를 중단하였다. CHA 2DS 2-VASc 점수 2점 (45.4%)과 3점 (23.2%) 환자들이 전체의 68.8%를 차지하였다. 재발의 위험성이 높은 경우와 이전에 혈전색전증이 있었던 경우에는 시술 후 6-12개월간 항응고제를 유지하였으며 이후 항혈소판제를 복용하였다. 46개월 추적관찰 기간 동안 82%의 환자가 심방세동이 재발하지 않았다. 289 (91%)명의 환자에서 항응고제를 중단하였고 293 (89%)명의 환자에서 항부정맥제를 중단하였지만 증상이 있는 허혈성 뇌혈관질환은 관찰되지 않았다. 또 다른 연구는 심방세동 시술 후 항응고제의 사용경향과 심장색전증의 위험도에 관하여 보고하였다[ 38]. 2005년에는 NOAC사용이 0%였으나 2014년에는 69.8%로 증가하였다. 항응고제 중단율은 높아서 3개월째는 60.5%, 12개월째는 31.3%에서만 약제를 복용하고 있었다. 중단율은 저위험군에서 더 높았다(CHA 2DS 2-VASc 0 또는 1 과 2이상인 군에서 12개월 중단율은 각각 82% 대 62.5%; p<0.001). 추적관찰 기간 중 뇌졸중은 CHA 2DS 2-VASc 2이상인 환자군에서 1.4% 발생하였고 0 또는 1인 환자에서 0.3% 발생하였다. 항응고제를 중단한 경우에 3개월 이후 심장색전증의 위험은 고위험군에서 더 높았지만 (HR 2.48; 95% CI 1.11-5.52; p<0.05) 저위험군에서는 위험도가 증가하지 않았다. 이러한 결과를 토대로 볼 때 최소 3개월은 모든 환자에서 항응고요법을 시행하고 고위험군에서는 평생 사용하는 것이 심방세동의 재발을 진단할 수 있는 완전한 방법이 없는 현실에서는 가장 안전한 전략이라고 할 수 있다. 독일의 심방세동 시술 등록연구에서 발작성 심방세동 시술 후 이전 뇌졸중 병력이 있는 고위험군과 뇌졸중 병력이 없는 저위험군을 비교한 연구결과를 발표하였다[ 39]. 2008년 4월부터 2011년 4월까지 고위험군 83명과 저위험군 377명이 등록되었다. 고위험군과 저위험군의 평균 CHA 2DS 2-VASc 점수는 각각 4.2 ± 1.4 와 1.6 ± 1.2 이었다 ( p<0.001). 추적관찰기간 중 고위험군에서는 항응고제를 38.6%에서 중단하였으며 저위험군에서는 66.3%에서 중단하였다( p<0.001). 혈전색전증은 고위험군에서 4.3%, 저위험군에서는 0.3%가 발생하여 ( p<0.001) 지속적인 맥박확인과 심전도 모니터링 없이 고위험군에서 항응고제를 중단하는 것은 위험하다는 결과를 보여주었다. 또 다른 연구는 삽입형 심전도 모니터를 통해 심방세동의 양에 따라 항응고제를 중단하는 것에 대하여 조사하였다[ 35]. 32±12 개월(126 인-년) 추적관찰 기간 동안 65명 중 41명 (63%)의 환자가 하루 1시간 이내의 심방세동을 보였고 항응고제를 중단할 수 있었다. 21명 (32%)은 1시간 이상의 심방세동을 보여 항응고제를 다시 시작하였고 3명은 다른 이유로 다시 시작하였다. 추적관찰 기간 동안 뇌졸중, 일과성허혈발작, 또는 다른 혈전색전증이 발생하지 않았다. 이 데이터는 항응고제 중단을 원하는 환자들에게 중요하며 모니터링을 통해 심방세동의 양에 따라 항응고요법을 결정할 것을 권장한다. 또 다른 연구에서는 5개의 대규모 센터에서 시술을 받은 3,344명의 데이터를 분석하여 발표하였다[ 40]. 항응고제는 다음과 같은 사항에 해당되지 않을 경우에는 CHA 2DS 2-VASc 점수와 관계없이 중단하였다: (1) 심방부정맥의 재발; (2) 중증 폐정맥 협착; (3) 중증 좌심방 기능장애. 항응고제를 중단한 후에는 아스피린을 처방하였다. 심방세동이 재발한 경우 CHA 2DS 2-VASc 점수가 1점 이상인 경우는 항응고제를 다시 시작하였다. CHA 2DS 2-VASc 점수가 >2 인 환자는 347명이었다. 347명의 환자에서 혈전색전증은 발생하지 않았다. 최근에 발표된 연구 중의 하나로 스웨덴의 국가 건강 등록연구가 있다[ 41]. 1년이상 추적관찰 한 1,175명의 환자에서 30%가 1년이내 와파린을 중단하였다. CHA 2DS 2-VASc 점수가 2점을 넘을 경우에는 와파린을 중단한 환자군에서 허혈성 뇌줄중 발생률이 더 높았다 (1.6%/년 대 0.3%/년). CHA 2DS 2-VASc 점수가 2점을 넘고 이전에 뇌졸중의 병력이 있는 경우는 와파린을 중단할 경우 특히 뇌졸중 위험이 높았다 (HR 4.6). 이 연구에서는 시술 후 재발이 매우 높았다는 점이 주목할 만 하다. 60%의 환자와 뇌졸중이 발생한 11명 중 8명 (72.7%)의 환자에서 전기적 율동 전환술이나 재시술이 시행되었다. 이 연구는 시술 후 심방부정맥이 재발한 환자들에서 CHA 2DS 2-VASc 점수가 높고 이전에 뇌졸중의 병력이 있는 경우 항응고제를 중단하면 안 된다는 것을 분명히 보여주었다. 재발하지 않은 환자가 매우 적었기 때문에 성공적인 시술이 뇌졸중 위험도를 낮추어 주는가에 대해서는 판단하기 어렵다. 우리나라에서 시행된 연구에서는 총 721명의 환자들 중 심방세동이 재발하지 않은 608명을 추적관찰 하였을 때 CHA 2DS 2-VASc 점수가 ≥ 2 인 259명 에서도 아스피린과 와파린군 간에 혈전색전증이나 주요 출혈에 있어서 차이가 없었다[ 42]. 또 다른 국내 연구에서는 심방세동 전극도자절제술을 받은 1,548명을 추적관찰 하였을 때 동율동이 유지되는 경우 심방세동이 재발한 경우에 비해 뇌졸중 발생이 유의하게 적었으나 CHA 2DS 2-VASc 점수가 ≥ 4 인 경우에는 동율동이 유지되더라도 뇌줄중 발생이 증가하는 것으로 나타났다[ 43]. 이와 같이 현재까지는 다양한 결과가 혼재되어 있는 상태이며 무작위 연구인 OCEAN (Optimal Anticoagulation for Higher Risk Patients Post-Catheter Ablation for Atrial Fibrillation) 연구가 시술을 통해 심방세동을 줄이거나 없앴을 때 장기간의 항응고 요법을 하지 않아도 되는지에 대한 답을 줄 수 있을 것으로 예상된다. 이러한 연구들의 결과가 나올 때까지는 뇌졸중의 고위험군에서는 시술 후 항응고제를 중단하지 말고 계속 사용하여야 한다. 시술 후 심방세동의 재발이 확인되지 않았고 항응고제의 중단을 원하지만 CHA 2DS 2-VASc 점수가 높은 경우에는 위험성과 이득에 대해서 환자와 충분한 상의를 한 후 개별적으로 결정하여야 한다. 항응고제 중단을 원하는 환자는 잠재적인 위험에 대하여 충분히 알고 있어야 한다. 심방세동의 수술적 치료 후에 적절한 항응고요법에 대해서는 데이터가 더 부족한 실정이다. 좌심방이를 절제하였는지 환자의 뇌졸중 위험도는 어느 정도인지 등 다양한 변수를 고려하여야 한다. 좌심방이가 외과적으로 제거되었을 때 항응고제의 사용에 대해서는 아직 데이터가 거의 없는 상태이다. 항응고제를 사용할 지, 어느 정도 기간 동안 사용할 지에 대해서는 각각의 환자의 위험성과 이득을 고려하여 결정해야 한다. 하지만, 출혈의 위험성이 높지 않다면 수술 후 수개월간 항응고제를 사용하는 것은 합리적이라고 생각된다. 수술적으로 좌심방이를 폐쇄하였거나 결찰한 환자에서 항응고요법의 중단을 고려하고 있다면 수술 후 불완전한 폐쇄가 드물지 않으므로 경식도초음파를 시행해서 좌심방이가 완전히 폐쇄되었는지 확인하는 것이 권장된다.
1. 심방세동 카테터 절제술 전에 항응고제를 투여하지 않고 시술 후 와파린을 사용하는 환자에서, 시술 후 와파린 항응고치료를 시작하기에 앞서 저 분자량 헤파린 또는 정맥 내 헤파린을 사용해야 한다. (I) 2. 와파린 또는 NOAC을 이용한 항응고 요법은 심방세동 시술 후 2개월 이상 유지하는 것이 좋다. (I) 3. 심방세동 시술의 성공여부와 관계 없이 항응고요법은 가이드라인에 따라 시행하는 것이 권장된다. (I) 4. 시술 2개월 후의 항응고요법은 시술의 성공여부가 아니라 환자의 뇌졸중 위험도에 따라 결정해야 한다. (I) 5. 심방세동 카테터 절제술 전에 항응고제를 투여하지 않았거나 절제술 전에 NOAC 또는 와파린을 중단했던 환자의 경우 지혈완료 후 3-5시간 후에 NOAC을 재투여할 것을 권고한다. (IIa) 6. 환자의 선호도에 따라 항응고요법의 중단을 고려하는 경우에는 심방세동의 재발을 스크리닝하기 위해 홀터나 심전도 검사를 자주 시행할 것을 고려해야 한다. (IIa)
시술 중 마취 또는 진정
심방세동 시술을 받는 환자들은 수시간 동안 움직이지 않고 누워있어야 하고 전극도자절제술을 통한 자극이 통증을 유발하므로 대부분의 환자들에서 의식 진정 또는 전신마취를 시행한다. 어떤 방법을 선택할 지는 기관이나 환자에 따라 달라진다.
전신마취
심방세동 시술은 흔히 전신마취 하에서 시행된다. 기도폐쇄의 위험이 있는 환자에서 시술의 안전성을 높여줄 뿐 아니라 환자도 편하고 시술 중에 환자의 움직임을 최소화하여 시술 결과도 향상시킬 수 있다. 환자의 움직임을 최소화하여 카테터와 3차원 지도화 시스템의 안정성을 향상시키기 위해서는 전신마취 또는 깊은 진정이 선호된다. 한 전향적 무작위 연구에서 전신마취와 의식 진정을 비교하였다[ 44]. 이 연구에서 전신마취를 하는 것이 1회 시술 성공률을 높였으며 재시술 시 폐정맥 재연결의 빈도를 낮추었고 시술시간과 방사선 조사시간을 줄여주었다. 전신마취는 수면무호흡증 같은 기도폐쇄의 위험이 높은 환자나 폐부종의 위험이 높은 환자에서 특히 유용하다. 또한 일반적인 환자에서도 시술을 좀 더 쉽게 받도록 선택적으로 시행될 수 있다. 마취나 진통제의 투여는 잘 훈련된 의료진이 심박수, 혈압, 산소포화도 등을 잘 관찰하면서 시행해야 한다.
의식 진정과 깊은 진정
깊은 진정은 전신 마취의 바로 전단계이다. 일반적으로 깊은 진정은 기도와 혈역동학적 관리가 필요할 수도 있기 때문에 마취과 의사나 전문적으로 훈련받은 인력에 의해서 시행되어야 한다. 깊은 진정의 주요 제한점은 시술 동안 환자가 움직이지 않고 시술 테이블 위에 지속적으로 누워 있는 것이 어렵다는 점이다. 고주파 절제술은 심한 통증을 유발하는데, 통증을 유발하는 부위는 후벽이 가장 흔하지만 예측 불가능한 경우가 많다. 깊은 진정 동안에도 식도 온도를 모니터링 할 수 있기는 하나 전신마취에 비교할 때 기도 반사가 억제되지 않아 어려움을 겪는 경우가 많다. 냉각풍선 절제술 동안 우측 횡격막 신경의 자극으로 인해 환자가 움직이는 것도 깊은 진정 중 흔히 일어나는 일이지만 전신마취 동안에는 보통 이러한 증상이 없다.
제트 환기
카테터의 안정성과 접촉이 효과적인 병변을 만들기 위해 매우 중요하다. 카테터의 안정성과 접촉력은 호흡으로 인한 흉곽의 운동이 줄어들면 더 좋아진다. 한 연구에서는 폐정맥 고립술 동안 전신마취에서 제트 환기를 할 경우 병변이 효과적으로 만들어지고 폐정맥 재연결이 줄어서 임상경과를 호전시키는 것으로 나타났다[ 45]. 하지만 최종적인 결론을 위해서는 다른 기관들에서의 추가 연구가 필요하다.
심방-식도 누공 위험을 최소화 하기 위한 방법
드물지만 치명적인 합병증이 식도손상이다. 심방-식도 누공 또는 식도 천공이 발생하여 종격동염, 뇌졸중, 사망을 일으킬 수 있다[ 46]. 우리나라 환자들을 대상으로 한 연구에서는 발생률과 사망률이 각각 0.15%와 80%로 보고되었다[ 47]. 또 다른 합병증은 위마비인데 식도주변의 미주신경이 열로 인해 손상을 받는 것이 기전으로 생각된다[ 48]. 식도-심방누공의 결과는 치명적이기 때문에 식도와 식도주변의 심각한 손상을 예방하는 것이 중요하다. 일부 시술자들은 식도를 피하도록 병변을 만든다. 식도의 위치는 CT [ 49], 3차원 지도화 시스템, 바륨 조영술, 심장내 초음파 등 다양한 방법으로 확인할 수 있으며 시술 중 식도의 위치가 변할 수 있기 때문에 이를 확인하기 위해서는 검사를 반복적으로 시행해야 한다. 하지만 식도와 가까운 곳에 전혀 병변을 만들지 않고 완전하게 폐정맥 고립술을 시행하기는 매우 어렵다. 식도 손상을 예방하고 치료하는 방법에 대해서 다음에 기술되어 있다.
후벽 시술 시 고주파 에너지 감소
고주파 에너지가 높을수록, 조직을 가열 또는 냉각시키는 깊이가 깊을수록 식도 손상의 위험이 올라간다. 식도와 가까운 후벽에 고주파 에너지를 가할 때 식도 손상을 줄이기 위해서 몇 가지 방법을 사용할 수 있다. (1) 고주파 에너지의 감소 (25W 이하) (2) 고주파 에너지 전달 시간의 감소 (20초 이하) (3) 접촉력의 감소 (10g 이하) 후벽 식도 근처에서 병변을 만들 때는 파워를 줄이는 것이 권고된다. 몇몇 연구에서는 약한 의식 진정을 하여 통증을 호소하는 것을 식도 손상의 지표로 삼기도 하였다. 하지만 통증 반응의 특이도에 대해서는 논란이 있다. 냉각풍선 절제술 같은 다른 에너지의 사용이 식도 손상을 줄여줄 수 있을 것으로 생각되었지만 냉각풍선 절제술 후에도 심방-식도 누공 또는 식도주변 미주신경 손상이 보고되었다[ 50]. 또한 고강도 집중 초음파 (high intensity focused ultrasound) 또는 레이저 에너지도 식도를 손상시킬 수 있는 것으로 보고되었다[ 51]. 각각의 기관에서 다양한 접근방법을 사용하고 있지만 심방-식도 누공의 발생이 매우 드물어서 어떤 방법이 적절한 지는 증명하기 어려운 상태이다.
식도 온도 모니터링
가장 많이 사용되는 방법은 식도 내의 온도를 모니터링하여 위험한 가열을 피하는 것이다[ 52, 53]. 불행하게도, 식도는 넓은데 온도 센서는 옆쪽으로 위치해 있어 절제술 카테터와 일렬로 배치되지 않으면 시술자는 잘못된 정보를 받을 수 있다. 식도 온도계를 사용하는 경우 온도가 상승하면 고주파 에너지 전달을 중단하는 것이 일반적이다. 일반적으로 기저치 보다 1-2℃ 상승하거나 39-40℃ 이면 절제술을 중단한다. 냉각풍선요법의 온도가 20-25℃까지 떨어지면 냉각을 중단한다. 다양한 식도 온도계가 임상에서 사용 가능하다[ 54]. 최근 한 연구에서 다중센서 온도계가 열역동학적으로 우월하다고 하였으나 심방-식도 누공을 줄여주는지에 대한 임상연구는 없다[ 55]. 이러한 연구는 심방-식도 누공의 발생률이 워낙 낮기 때문에 실제적으로 거의 불가능하다. 다중센서의 장점은 복잡성과 비용의 증가를 고려하여 평가하여야 한다. 다른 전략은 식도를 냉각시키는 것인데 이 방법은 큰 규모의 연구에서 평가되지 않았고 데이터는 제한적이다[ 56]. 몇몇 시술자는 식도의 위치를 기계적으로 바꾸는 방법을 사용한다[ 57]. 이 방법은 전망이 밝아 보이나 아직까지 소수의 환자에서만 사용되었기 때문에 증명되지 않은 방법이다.
약제에 의한 예방
식도 궤양은 심방세동 절제술 후 약 5-40%에서 발견된다. 심방-식도 누공은 심방과 식도 전층에 걸쳐서 괴사가 일어나고 이후에 위식도 역류에 의해 궤양과 미란이 발생하는 것이 원인으로 생각되고 있다[ 58]. 궤양과 미란의 발생을 예방하기 위해 양성자 펌프 억제제 (proton pump inhibitor, PPI)가 사용되고 있다. PPI는 위액의 산성도를 줄이고 식도염을 치유하여 위식도 역류성 질환에서 매우 효과적이다[ 59]. PPI는 의인성 궤양의 크기를 줄이는 데도 효과적이기 때문에 전극도자절제술로 인해 발생한 궤양에도 도움이 될 것으로 생각된다. 식도의 기계적인 손상과 같은 다른 기전도 심방-식도 누공에 작용할 것으로 생각되나 아직 증명된 바는 없다. 시술 후 단기간 PPI를 사용하는 것이 효과적일 것으로 생각되나 PPI가 실제로 심방-식도 누공을 줄이는지는 대규모의 무작위 연구를 통해 증명되어야 할 것이다. 하지만 심방-식도 누공의 발생률이 워낙 낮기 때문에 이러한 연구는 실제로 시행되기 어렵다. 현재로서는 PPI 치료가 유일한 예방적인 치료로서 받아들여지고 있다.
시술 후 내시경을 통한 스크리닝 검사의 역할과 적응증
심방-식도 누공은 패혈증과 공기 색전증을 일으켜 사망에 이르기 때문에 조기에 식도 손상을 발견하는 것이 매우 중요하다. 내시경을 통해 식도 병변을 찾아내는 것에 대한 데이터는 제한적이다. 시술 후 내시경을 시행받은 185명의 환자에서 궤양이나 출혈성 병변은 14.6%에서 발견되었다[ 60]. 이러한 병변은 식도 온도가 41℃를 넘었을 때만 관찰되었다. 1℃가 상승할 때마다 위험도는 1.36배로 상승하였다 (95% CI 1.07-1.74; p=0.012). 식도 온도가 41℃를 넘었던 경우 시술 후 1-3일째 내시경을 시행한 425명의 환자에 대한 분석에서는 무증상 식도병변이 11.6%에서 관찰되었다[ 61]. 따라서 식도 온도가 특정 수준 (예를 들면, 41℃)을 넘는 경우 내시경을 시행하면 도움을 받을 수 있을 것으로 보인다. 하지만, 시술 후 추적 내시경을 시행하는 것에 대해서는 아직까지 보고가 없는 실정이다. 한 연구에서 병변 크기가 5mm가 넘는 환자에서 적어도 일주일 뒤에 추적검사를 하였을 때 3,168개의 병변 모두가 줄어들었음을 보여주었다. PPI는 모든 환자에서 시술 후 4주간 사용하였다[ 61].
심방-식도 누공의 진단을 위한 CT의 역할과 적응증
시술 후에 심방-식도 누공으로 진행하는 것을 시사하는 증상과 징후는 흉통, 연하통, 고열, 백혈구 증가, 일과성 허혈발작, 뇌졸중 등이며 특징적으로 1에서 3주 사이에 발생한다[ 47]. 식도 손상이 의심되면 수용성 정맥 조영제를 사용한 CT 촬영이 권장된다[ 62]. CT상 종격동 또는 심낭 내 공기, 식도와 심외막 또는 심방의 교통, 그리고 식도와 심장사이의 조직염증이 관찰될 수 있다. 불행하게도 이러한 소견들은 심방-식도 누공이 진행된 후 늦게 발견된다. 초기에는 CT 소견이 완전히 정상일 수 있다. 식도 손상이 의심되지만 CT가 정상인 경우, 진단을 배제하지 말고 증상이 없어지지 않는 한 검사를 반복하여 시행해야 한다. 식도 초음파도 단순 궤양을 넘어서 근육층과 외부 손상을 볼 수 있기 때문에 유용하다. 바륨 조영술은 누공을 발견할 수 있지만 민감도가 낮다. 심방-식도 누공이 의심되는 경우 공기를 주입하는 내시경은 피해야 한다. 대량의 공기 색전증을 유발하여 뇌졸중이나 사망에 이를 수 있다. 대안으로서 CO 2 가스를 이용한 내시경이 위험성을 줄일 수 있다. CO 2 가스는 좌심방으로 들어가더라도 위험성이 거의 없다. 이 드문 합병증에 대한 인지를 못하기 때문에 조기 진단을 놓치는 경우가 있을 수 있다. 환자들에게 경고 증상에 대하여 설명하고 증상이 있을 경우 즉시 시술을 받은 병원으로 연락을 할 수 있도록 교육하는 것이 중요하다.
심방-식도 누공의 치료
심방-식도 누공의 치료는 예방적 방법과 치료적 방법으로 나뉜다. 심방-식도 누공이 진단되면 치료적인 방법은 다음과 같은 것들이 있다.
(1) 개흉술을 통한 누공의 수술적 교정 (누공이 다시 개통되는 것을 막기 위해 늑골근육 피판을 사이에 위치시키는 좌심방과 식도의 교정술)
(2) 덜 침습적인 식도 스텐트 후 장기간의 항생제 사용
(3) 흉관 배액과 패혈증 치료를 통한 보존적 치료
위 세가지 방법 중 보존적 치료는 사망률이 매우 높다. 비슷하게 식도 스텐트도 초기 연구는 대부분의 경우에서 사망하고 응급수술을 받은 일부에서만 생존한 것으로 보고하였다[ 63]. 수술적인 치료에 대한 결과도 혼재되어 있어서 일부는 긍정적인 결과를 보였고 일부는 치명적인 결과를 나타냈다[ 63]. 하지만 현재까지 보고된 유일한 생존 방법은 수술적 교정을 시행하는 것이고 수술의 실패는 대부분 진단과 치료가 늦어졌기 때문이다. 따라서 현재까지의 정보를 종합하면, 조기에 수술적 치료를 하는 것이 생존을 위해 가장 필수적이라고 할 수 있다. 관상정맥동과 연결된 심장-식도 누공과 식도-심낭 누공의 경우 스텐트로 치료한 몇몇 보고들이 있다[ 64, 65]. 열에 의한 손상이 아닌 천공의 경우 누공이 형성되기 전에 스텐트나 내시경 클립으로 치료하는 것을 고려해 볼 수 있다[ 66].
References
1. Cox JL, Canavan TE, Schuessler RB, Cain ME, Lindsay BD, Stone C, Smith PK, Corr PB, Boineau JP. The surgical treatment of atrial fibrillation. II. Intraoperative electrophysiologic mapping and description of the electrophysiologic basis of atrial flutter and atrial fibrillation. J Thorac Cardiovasc Surg 1991; 101: 406-426.  2. Sundt TM, 3rd., Camillo CJ, Cox JL. The maze procedure for cure of atrial fibrillation. Cardiol Clin 1997; 15: 739-748.   3. Melo J, Adragão P, Neves J, Ferreira MM, Pinto MM, Rebocho MJ, Parreira L, Ramos T. Surgery for atrial fibrillation using radiofrequency catheter ablation: assessment of results at one year. Eur J Cardiothorac Surg 1999; 15: 851-854.   4. Sueda T, Imai K, Ishii O, Orihashi K, Watari M, Okada K. Efficacy of pulmonary vein isolation for the elimination of chronic atrial fibrillation in cardiac valvular surgery. Ann Thorac Surg 2001; 71: 1189-1193.  5. Haïssaguerre M, Jaïs P, Shah DC, Gencel L, Pradeau V, Garrigues S, Chouairi S, Hocini M, Le Métayer P, Roudaut R, Clémenty J. Right and left atrial radiofrequency catheter therapy of paroxysmal atrial fibrillation. J Cardiovasc Electrophysiol 1996; 7: 1132-1144.   6. Gaita F, Riccardi R, Calò L, Scaglione M, Garberoglio L, Antolini R, Kirchner M, Lamberti F, Richiardi E. Atrial mapping and radiofrequency catheter ablation in patients with idiopathic atrial fibrillation. Electrophysiological findings and ablation results. Circulation 1998; 97: 2136-2145.   7. Jais P, Shah DC, Takahashi A, Hocini M, Haissaguerre M, Clementy J. Long-term follow-up after right atrial radiofrequency catheter treatment of paroxysmal atrial fibrillation. Pacing Clin Electrophysiol 1998; 21: 2533-2538.   8. Calkins H, Hall J, Ellenbogen K, Walcott G, Sherman M, Bowe W, Simpson J, Castellano T, Kay GN. A new system for catheter ablation of atrial fibrillation. Am J Cardiol 1999; 83: 227D-36D.   9. Natale A, Leonelli F, Beheiry S, Newby K, Pisano E, Potenza D, Rajkovich K, Wides B, Cromwell L, Tomassoni G. Catheter ablation approach on the right side only for paroxysmal atrial fibrillation therapy: long-term results. Pacing Clin Electrophysiol 2000; 23: 224-233.   10. Haïssaguerre M, Jaïs P, Shah DC, Takahashi A, Hocini M, Quiniou G, Garrigue S, Le Mouroux A, Le Métayer P, Clémenty J. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. N Engl J Med 1998; 339: 659-666.   11. Haissaguerre M, Marcus FI, Fischer B, Clementy J. Radiofrequency catheter ablation in unusual mechanisms of atrial fibrillation: report of three cases. J Cardiovasc Electrophysiol 1994; 5: 743-751.   12. Jaïs P, Haïssaguerre M, Shah DC, Chouairi S, Gencel L, Hocini M, Clémenty J. A focal source of atrial fibrillation treated by discrete radiofrequency ablation. Circulation 1997; 95: 572-576.   13. Pappone C, Oreto G, Lamberti F, Vicedomini G, Loricchio ML, Shpun S, Rillo M, Calabrò MP, Conversano A, Ben-Haim SA, Cappato R, Chierchia S. Catheter ablation of paroxysmal atrial fibrillation using a 3D mapping system. Circulation 1999; 100: 1203-1208.   14. Haïssaguerre M, Jaïs P, Shah DC, Garrigue S, Takahashi A, Lavergne T, Hocini M, Peng JT, Roudaut R, Clémenty J. Electrophysiological end point for catheter ablation of atrial fibrillation initiated from multiple pulmonary venous foci. Circulation 2000; 101: 1409-1417.   15. Pappone C, Rosanio S, Oreto G, Tocchi M, Gugliotta F, Vicedomini G, Salvati A, Dicandia C, Mazzone P, Santinelli V, Gulletta S, Chierchia S. Circumferential radiofrequency ablation of pulmonary vein ostia: A new anatomic approach for curing atrial fibrillation. Circulation 2000; 102: 2619-2628.   16. Robbins IM, Colvin EV, Doyle TP, Kemp WE, Loyd JE, McMahon WS, Kay GN. Pulmonary vein stenosis after catheter ablation of atrial fibrillation. Circulation 1998; 98: 1769-1775.   17. Marrouche NF, Martin DO, Wazni O, Gillinov AM, Klein A, Bhargava M, Saad E, Bash D, Yamada H, Jaber W, Schweikert R, Tchou P, Abdul-Karim A, Saliba W, Natale A. Phased-array intracardiac echocardiography monitoring during pulmonary vein isolation in patients with atrial fibrillation: impact on outcome and complications. Circulation 2003; 107: 2710-2716.   18. Pappone C, Oreto G, Rosanio S, Vicedomini G, Tocchi M, Gugliotta F, Salvati A, Dicandia C, Calabrò MP, Mazzone P, Ficarra E, Di Gioia C, Gulletta S, Nardi S, Santinelli V, Benussi S, Alfieri O. Atrial electroanatomic remodeling after circumferential radiofrequency pulmonary vein ablation: efficacy of an anatomic approach in a large cohort of patients with atrial fibrillation. Circulation 2001; 104: 2539-2544.   19. Ouyang F, Bänsch D, Ernst S, Schaumann A, Hachiya H, Chen M, Chun J, Falk P, Khanedani A, Antz M, Kuck KH. Complete isolation of left atrium surrounding the pulmonary veins: new insights from the double-Lasso technique in paroxysmal atrial fibrillation. Circulation 2004; 110: 2090-2096.   20. Takahashi A, Iesaka Y, Takahashi Y, Takahashi R, Kobayashi K, Takagi K, Kuboyama O, Nishimori T, Takei H, Amemiya H, Fujiwara H, Hiraoka M. Electrical connections between pulmonary veins: implication for ostial ablation of pulmonary veins in patients with paroxysmal atrial fibrillation. Circulation 2002; 105: 2998-3003.   21. Callans DJ, Gerstenfeld EP, Dixit S, Zado E, Vanderhoff M, Ren JF, Marchlinski FE. Efficacy of repeat pulmonary vein isolation procedures in patients with recurrent atrial fibrillation. J Cardiovasc Electrophysiol 2004; 15: 1050-1055.   22. Arentz T, Weber R, Bürkle G, Herrera C, Blum T, Stockinger J, Minners J, Neumann FJ, Kalusche D. Small or large isolation areas around the pulmonary veins for the treatment of atrial fibrillation? Results from a prospective randomized study. Circulation 2007; 115: 3057-3063.   23. Oral H, Scharf C, Chugh A, Hall B, Cheung P, Good E, Veerareddy S, Pelosi F, Jr., Morady F. Catheter ablation for paroxysmal atrial fibrillation: segmental pulmonary vein ostial ablation versus left atrial ablation. Circulation 2003; 108: 2355-2360.   24. Karch MR, Zrenner B, Deisenhofer I, Schreieck J, Ndrepepa G, Dong J, Lamprecht K, Barthel P, Luciani E, Schömig A, Schmitt C. Freedom from atrial tachyarrhythmias after catheter ablation of atrial fibrillation: a randomized comparison between 2 current ablation strategies. Circulation 2005; 111: 2875-2880.   25. Yamada T, Murakami Y, Okada T, Okamoto M, Shimizu T, Toyama J, Yoshida Y, Tsuboi N, Ito T, Muto M, Kondo T, Inden Y, Hirai M, Murohara T. Electrophysiological pulmonary vein antrum isolation with a multielectrode basket catheter is feasible and effective for curing paroxysmal atrial fibrillation: efficacy of minimally extensive pulmonary vein isolation. Heart Rhythm 2006; 3: 377-384.   26. Gerstenfeld EP, Dixit S, Callans D, Rho R, Rajawat Y, Zado E, Marchlinski FE. Utility of exit block for identifying electrical isolation of the pulmonary veins. J Cardiovasc Electrophysiol 2002; 13: 971-979.   27. Calkins H, Kuck KH, Cappato R, Brugada J, Camm AJ, Chen SA, Crijns HJ, Damiano RJ, Jr., Davies DW, DiMarco J, Edgerton J, Ellenbogen K, Ezekowitz MD, Haines DE, Haissaguerre M, Hindricks G, Iesaka Y, Jackman W, Jalife J, Jais P, Kalman J, Keane D, Kim YH, Kirchhof P, Klein G, Kottkamp H, Kumagai K, Lindsay BD, Mansour M, Marchlinski FE, McCarthy PM, Mont JL, Morady F, Nademanee K, Nakagawa H, Natale A, Nattel S, Packer DL, Pappone C, Prystowsky E, Raviele A, Reddy V, Ruskin JN, Shemin RJ, Tsao HM, Wilber D; Heart Rhythm Society Task Force on Catheter and Surgical Ablation of Atrial Fibrillation.2012 HRS/EHRA/ECAS expert consensus statement on catheter and surgical ablation of atrial fibrillation: recommendations for patient selection, procedural techniques, patient management and follow-up, definitions, endpoints, and research trial design: a report of the Heart Rhythm Society (HRS) Task Force on Catheter and Surgical Ablation of Atrial Fibrillation. Developed in partnership with the European Heart Rhythm Association (EHRA), a registered branch of the European Society of Cardiology (ESC) and the European Cardiac Arrhythmia Society (ECAS); and in collaboration with the American College of Cardiology (ACC), American Heart Association (AHA), the Asia Pacific Heart Rhythm Society (APHRS), and the Society of Thoracic Surgeons (STS). Endorsed by the governing bodies of the American College of Cardiology Foundation, the American Heart Association, the European Cardiac Arrhythmia Society, the European Heart Rhythm Association, the Society of Thoracic Surgeons, the Asia Pacific Heart Rhythm Society, and the Heart Rhythm Society. Heart Rhythm 2012; 9: 632-696 e21.    28. Verma A, Jiang CY, Betts TR, Chen J, Deisenhofer I, Mantovan R, Macle L, Morillo CA, Haverkamp W, Weerasooriya R, Albenque JP, Nardi S, Menardi E, Novak P, Sanders P; STAR AF II Investigators. Approaches to catheter ablation for persistent atrial fibrillation. N Engl J Med 2015; 372: 1812-1822.   29. Verma A, Kilicaslan F, Pisano E, Marrouche NF, Fanelli R, Brachmann J, Geunther J, Potenza D, Martin DO, Cummings J, Burkhardt JD, Saliba W, Schweikert RA, Natale A. Response of atrial fibrillation to pulmonary vein antrum isolation is directly related to resumption and delay of pulmonary vein conduction. Circulation 2005; 112: 627-635.   30. Nanthakumar K, Plumb VJ, Epstein AE, Veenhuyzen GD, Link D, Kay GN. Resumption of electrical conduction in previously isolated pulmonary veins: rationale for a different strategy? Circulation 2004; 109: 1226-1229.   31. Ouyang F, Antz M, Ernst S, Hachiya H, Mavrakis H, Deger FT, Schaumann A, Chun J, Falk P, Hennig D, Liu X, Bänsch D, Kuck KH. Recovered pulmonary vein conduction as a dominant factor for recurrent atrial tachyarrhythmias after complete circular isolation of the pulmonary veins: lessons from double Lasso technique. Circulation 2005; 111: 127-135.   32. Cheema A, Dong J, Dalal D, Marine JE, Henrikson CA, Spragg D, Cheng A, Nazarian S, Bilchick K, Sinha S, Scherr D, Almasry I, Halperin H, Berger R, Calkins H. Incidence and time course of early recovery of pulmonary vein conduction after catheter ablation of atrial fibrillation. J Cardiovasc Electrophysiol 2007; 18: 387-391.   33. Pratola C, Baldo E, Notarstefano P, Toselli T, Ferrari R. Radiofrequency ablation of atrial fibrillation: is the persistence of all intraprocedural targets necessary for long-term maintenance of sinus rhythm? Circulation 2008; 117: 136-143.   34. Rajappan K, Kistler PM, Earley MJ, Thomas G, Izquierdo M, Sporton SC, Schilling RJ. Acute and chronic pulmonary vein reconnection after atrial fibrillation ablation: a prospective characterization of anatomical sites. Pacing Clin Electrophysiol 2008; 31: 1598-1605.   35. Bänsch D, Bittkau J, Schneider R, Schneider C, Wendig I, Akin I, Nienaber CA. Circumferential pulmonary vein isolation: wait or stop early after initial successful pulmonary vein isolation? Europace 2013; 15: 183-188.   36. Nakamura K, Naito S, Kaseno K, Tsukada N, Sasaki T, Hayano M, Nishiuchi S, Fuke E, Miki Y, Sakamoto T, Nakamura K, Kumagai K, Kataoka A, Takaoka H, Kobayashi Y, Funabashi N, Oshima S. Optimal observation time after completion of circumferential pulmonary vein isolation for atrial fibrillation to prevent chronic pulmonary vein reconnections. Int J Cardiol 2013; 168: 5300-5310.   37. Neuzil P, Reddy VY, Kautzner J, Petru J, Wichterle D, Shah D, Lambert H, Yulzari A, Wissner E, Kuck KH. Electrical reconnection after pulmonary vein isolation is contingent on contact force during initial treatment: results from the EFFICAS I study. Circ Arrhythm Electrophysiol 2013; 6: 327-333.   38. Jiang RH, Po SS, Tung R, Liu Q, Sheng X, Zhang ZW, Sun YX, Yu L, Zhang P, Fu GS, Jiang CY. Incidence of pulmonary vein conduction recovery in patients without clinical recurrence after ablation of paroxysmal atrial fibrillation: mechanistic implications. Heart Rhythm 2014; 11: 969-976.   39. Kim TH, Park J, Uhm JS, Joung B, Lee MH, Pak HN. Pulmonary vein reconnection predicts good clinical outcome after second catheter ablation for atrial fibrillation. Europace 2017; 19: 961-967.   40. Kuck KH, Hoffmann BA, Ernst S, Wegscheider K, Treszl A, Metzner A, Eckardt L, Lewalter T, Breithardt G, Willems S; Gap-AF-AFNET 1 Investigators. Impact of Complete Versus Incomplete Circumferential Lines Around the Pulmonary Veins During Catheter Ablation of Paroxysmal Atrial Fibrillation: Results From the Gap-Atrial Fibrillation-German Atrial Fibrillation Competence Network 1 Trial. Circ Arrhythm Electrophysiol 2016; 9: e003337.   41. Wang XH, Liu X, Sun YM, Gu JN, Shi HF, Zhou L, Hu W. Early identification and treatment of PV re-connections: role of observation time and impact on clinical results of atrial fibrillation ablation. Europace 2007; 9: 481-486.   42. Macle L, Khairy P, Weerasooriya R, Novak P, Verma A, Willems S, Arentz T, Deisenhofer I, Veenhuyzen G, Scavée C, Jaïs P, Puererfellner H, Levesque S, Andrade JG, Rivard L, Guerra PG, Dubuc M, Thibault B, Talajic M, Roy D, Nattel S; ADVICE trial investigators. Adenosine-guided pulmonary vein isolation for the treatment of paroxysmal atrial fibrillation: an international, multicentre, randomised superiority trial. Lancet 2015; 386: 672-679.   43. Yamane T, Matsuo S, Date T, Lellouche N, Hioki M, Narui R, Ito K, Tanigawa S, Yamashita S, Tokuda M, Yoshida H, Inada K, Shibayama K, Miyanaga S, Miyazaki H, Abe K, Sugimoto K, Yoshimura M. Repeated provocation of time- and ATP-induced early pulmonary vein reconnections after pulmonary vein isolation: eliminating paroxysmal atrial fibrillation in a single procedure. Circ Arrhythm Electrophysiol 2011; 4: 601-608.   44. Kobori A, Shizuta S, Inoue K, Kaitani K, Morimoto T, Nakazawa Y, Ozawa T, Kurotobi T, Morishima I, Miura F, Watanabe T, Masuda M, Naito M, Fujimoto H, Nishida T, Furukawa Y, Shirayama T, Tanaka M, Okajima K, Yao T, Egami Y, Satomi K, Noda T, Miyamoto K, Haruna T, Kawaji T, Yoshizawa T, Toyota T, Yahata M, Nakai K, Sugiyama H, Higashi Y, Ito M, Horie M, Kusano KF, Shimizu W, Kamakura S, Kimura T; UNDER-ATP Trial Investigators. Adenosine triphosphate-guided pulmonary vein isolation for atrial fibrillation: the UNmasking Dormant Electrical Reconduction by Adenosine TriPhosphate (UNDERATP) trial. Eur Heart J 2015; 36: 3276-3287.   45. Tritto M, De Ponti R, Salerno-Uriarte JA, Spadacini G, Marazzi R, Moretti P, Lanzotti M. Adenosine restores atrio-venous conduction after apparently successful ostial isolation of the pulmonary veins. Eur Heart J 2004; 25: 2155-2163.   46. Datino T, Macle L, Qi XY, Maguy A, Comtois P, Chartier D, Guerra PG, Arenal A, Fernández-Avilés F, Nattel S. Mechanisms by which adenosine restores conduction in dormant canine pulmonary veins. Circulation 2010; 121: 963-972.   47. Cha MJ, Choi EK, Oh S. Comparison between local and systemic injection of adenosine for detecting dormant conduction after PV isolation. Pacing Clin Electrophysiol 2017; 40: 762-769.   48. Kim JY, Kim SH, Song IG, Kim YR, Kim TS, Kim JH, Jang SW, Lee MY, Rho TH, Oh YS. Achievement of successful pulmonary vein isolation: methods of adenosine testing and incremental benefit of exit block. J Interv Card Electrophysiol 2016; 46: 315-324.   49. Kapa S, Killu A, Deshmukh A, Mulpuru SK, Asirvatham SJ. Dose-dependent pulmonary vein reconnection in response to adenosine: relevance of atrioventricular block during infusion. J Interv Card Electrophysiol 2016; 47: 117-123.   50. Dallaglio PD, Betts TR, Ginks M, Bashir Y, Anguera I, Rajappan K. The Role of Adenosine in Pulmonary Vein Isolation: A Critical Review. Cardiol Res Pract 2016; 2016: 8632509.    51. Miyazaki S, Kuwahara T, Kobori A, Takahashi Y, Takei A, Sato A, Isobe M, Takahashi A. Impact of adenosine-provoked acute dormant pulmonary vein conduction on recurrence of atrial fibrillation. J Cardiovasc Electrophysiol 2012; 23: 256-260.   52. Zhang J, Tang C, Zhang Y, Su XI. Origin and ablation of the adenosine triphosphate induced atrial fibrillation after circumferential pulmonary vein isolation: effects on procedural success rate. J Cardiovasc Electrophysiol 2014; 25: 364-370.   53. Datino T, Macle L, Chartier D, Comtois P, Khairy P, Guerra PG, Fernandez-Aviles F, Nattel S. Differential effectiveness of pharmacological strategies to reveal dormant pulmonary vein conduction: a clinical-experimental correlation. Heart Rhythm 2011; 8: 1426-1433.   54. Eitel C, Hindricks G, Sommer P, Gaspar T, Kircher S, Wetzel U, Dagres N, Esato M, Bollmann A, Husser D, Hilbert S, Zaker-Shahrak R, Arya A, Piorkowski C. Circumferential pulmonary vein isolation and linear left atrial ablation as a single-catheter technique to achieve bidirectional conduction block: the paceand-ablate approach. Heart Rhythm 2010; 7: 157-164.   55. Steven D, Reddy VY, Inada K, Roberts-Thomson KC, Seiler J, Stevenson WG, Michaud GF. Loss of pace capture on the ablation line: a new marker for complete radiofrequency lesions to achieve pulmonary vein isolation. Heart Rhythm 2010; 7: 323-330.   56. Andrade JG, Pollak SJ, Monir G, Khairy P, Dubuc M, Roy D, Talajic M, Deyell M, Rivard L, Thibault B, Guerra PG, Nattel S, Macle L. Pulmonary vein isolation using a pace-capture-guided versus an adenosine-guided approach: effect on dormant conduction and long-term freedom from recurrent atrial fibrillation--a prospective study. Circ Arrhythm Electrophysiol 2013; 6: 1103-1108.   57. Steven D, Sultan A, Reddy V, Luker J, Altenburg M, Hoffmann B, Rostock T, Servatius H, Stevenson WG, Willems S, Michaud GF. Benefit of pulmonary vein isolation guided by loss of pace capture on the ablation line: results from a prospective 2-center randomized trial. J Am Coll Cardiol 2013; 62: 44-50.   58. Weerasooriya R, Jaïs P, Le Heuzey JY, Scaveé C, Choi KJ, Macle L, Raybaud F, Hocini M, Shah DC, Lavergne T, Clémenty J, Haïssaguerre M. Cost analysis of catheter ablation for paroxysmal atrial fibrillation. Pacing Clin Electrophysiol 2003; 26: 292-294.   59. Vijayaraman P, Dandamudi G, Naperkowski A, Oren J, Storm R, Ellenbogen KA. Assessment of exit block following pulmonary vein isolation: far-field capture masquerading as entrance without exit block. Heart Rhythm 2012; 9: 1653-1659.   60. Perez FJ, Schubert CM, Parvez B, Pathak V, Ellenbogen KA, Wood MA. Long-term outcomes after catheter ablation of cavotricuspid isthmus dependent atrial flutter: a meta-analysis. Circ Arrhythm Electrophysiol 2009; 2: 393-401.   61. Patel NJ, Deshmukh A, Pau D, Goyal V, Patel SV, Patel N, Agnihotri K, Asirvatham S, Noseworthy P, Di Biase L, Natale A, Viles-Gonzalez JF. Contemporary utilization and safety outcomes of catheter ablation of atrial flutter in the United States: Analysis of 89,638 procedures. Heart Rhythm 2016; 13: 1317-1325.   62. azni O, Marrouche NF, Martin DO, Gillinov AM, Saliba W, Saad E, Klein A, Bhargava M, Bash D, Schweikert R, Erciyes D, Abdul-Karim A, Brachman J, Gunther J, Pisano E, Potenza D, Fanelli R, Natale A. Randomized study comparing combined pulmonary vein-left atrial junction disconnection and cavotricuspid isthmus ablation versus pulmonary vein-left atrial junction disconnection alone in patients presenting with typical atrial flutter and atrial fibrillation. Circulation 2003; 108: 2479-2483.   63. Natale A, Newby KH, Pisanó E, Leonelli F, Fanelli R, Potenza D, Beheiry S, Tomassoni G. Prospective randomized comparison of antiarrhythmic therapy versus first-line radiofrequency ablation in patients with atrial flutter. J Am Coll Cardiol 2000; 35: 1898-1904.   64. Pappone C, Manguso F, Vicedomini G, Gugliotta F, Santinelli O, Ferro A, Gulletta S, Sala S, Sora N, Paglino G, Augello G, Agricola E, Zangrillo A, Alfieri O, Santinelli V. Prevention of iatrogenic atrial tachycardia after ablation of atrial fibrillation: a prospective randomized study comparing circumferential pulmonary vein ablation with a modified approach. Circulation 2004; 110: 3036-3042.   65. Jang SW, Oh YS, Shin WS, Uhm JS, Kim SH, Kim JH, Lee MY, Rho TH. Impact of left anterior line on left atrial appendage contractility in patients who underwent catheter ablation for chronic atrial fibrillation. Pacing Clin Electrophysiol 2014; 37: 179-187.   66. Kim JS, Shin SY, Na JO, Choi CU, Kim SH, Kim JW, Kim EJ, Rha SW, Park CG, Seo HS, Oh DJ, Hwang C, Lim HE. Does isolation of the left atrial posterior wall improve clinical outcomes after radiofrequency catheter ablation for persistent atrial fibrillation?: A prospective randomized clinical trial. Int J Cardiol 2015; 181: 277-283.   67. Chae S, Oral H, Good E, Dey S, Wimmer A, Crawford T, Wells D, Sarrazin JF, Chalfoun N, Kuhne M, Fortino J, Huether E, Lemerand T, Pelosi F, Bogun F, Morady F, Chugh A. Atrial tachycardia after circumferential pulmonary vein ablation of atrial fibrillation: mechanistic insights, results of catheter ablation, and risk factors for recurrence. J Am Coll Cardiol 2007; 50: 1781-1787.   68. Yu HT, Shim J, Park J, Kim IS, Kim TH, Uhm JS, Joung B, Lee MH, Kim YH, Pak HN. Pulmonary Vein Isolation Alone Versus Additional Linear Ablation in Patients With Persistent Atrial Fibrillation Converted to Paroxysmal Type With Antiarrhythmic Drug Therapy: A Multicenter, Prospective, Randomized Study. Circ Arrhythm Electrophysiol 2017; 10.  69. Vogler J, Willems S, Sultan A, Schreiber D, Lüker J, Servatius H, Schäffer B, Moser J, Hoffmann BA, Steven D. Pulmonary Vein Isolation Versus Defragmentation: The CHASE-AF Clinical Trial. J Am Coll Cardiol 2015; 66: 2743-2752.   70. Ouyang F, Ernst S, Vogtmann T, Goya M, Volkmer M, Schaumann A, Bänsch D, Antz M, Kuck KH. Characterization of reentrant circuits in left atrial macroreentrant tachycardia: critical isthmus block can prevent atrial tachycardia recurrence. Circulation 2002; 105: 1934-1942.   71. Matsuo S, Wright M, Knecht S, Nault I, Lellouche N, Lim KT, Arantes L, O'Neill MD, Hocini M, Jaïs P, Haïssaguerre M. Perimitral atrial flutter in patients with atrial fibrillation ablation. Heart Rhythm 2010; 7: 2-8.   72. Kim TH, Park J, Uhm JS, Kim JY, Joung B, Lee MH, Pak HN. Challenging Achievement of Bidirectional Block After Linear Ablation Affects the Rhythm Outcome in Patients With Persistent Atrial Fibrillation. J Am Heart Assoc 2016; 5.  73. Scherr D, Khairy P, Miyazaki S, Aurillac-Lavignolle V, Pascale P, Wilton SB, Ramoul K, Komatsu Y, Roten L, Jadidi A, Linton N, Pedersen M, Daly M, O'Neill M, Knecht S, Weerasooriya R, Rostock T, Manninger M, Cochet H, Shah AJ, Yeim S, Denis A, Derval N, Hocini M, Sacher F, Haissaguerre M, Jais P. Five-year outcome of catheter ablation of persistent atrial fibrillation using termination of atrial fibrillation as a procedural endpoint. Circ Arrhythm Electrophysiol 2015; 8: 18-24.   74. Nademanee K, McKenzie J, Kosar E, Schwab M, Sunsaneewitayakul B, Vasavakul T, Khunnawat C, Ngarmukos T. A new approach for catheter ablation of atrial fibrillation: mapping of the electrophysiologic substrate. J Am Coll Cardiol 2004; 43: 2044-2053.   75. O'Neill MD, Wright M, Knecht S, Jaïs P, Hocini M, Takahashi Y, Jönsson A, Sacher F, Matsuo S, Lim KT, Arantes L, Derval N, Lellouche N, Nault I, Bordachar P, Clémenty J, Haïssaguerre M. Long-term follow-up of persistent atrial fibrillation ablation using termination as a procedural endpoint. Eur Heart J 2009; 30: 1105-1112.   76. Lo LW, Tai CT, Lin YJ, Chang SL, Udyavar AR, Hu YF, Ueng KC, Tsai WC, Tuan TC, Chang CJ, Kao T, Tsao HM, Wongcharoen W, Higa S, Chen SA. Predicting factors for atrial fibrillation acute termination during catheter ablation procedures: implications for catheter ablation strategy and long-term outcome. Heart Rhythm 2009; 6: 311-318.   77. Wynn GJ, Panikker S, Morgan M, Hall M, Waktare J, Markides V, Hussain W, Salukhe T, Modi S, Jarman J, Jones DG, Snowdon R, Todd D, Wong T, Gupta D. Biatrial linear ablation in sustained nonpermanent AF: Results of the substrate modification with ablation and antiarrhythmic drugs in nonpermanent atrial fibrillation (SMAN-PAF) trial. Heart Rhythm 2016; 13: 399-406.   78. Yamaguchi Y, Kumagai K, Nakashima H, Saku K. Long-term effects of box isolation on sympathovagal balance in atrial fibrillation. Circ J 2010; 74: 1096-1103.   79. Kumagai K. Catheter ablation of atrial fibrillation. -State of the Art. Circ J 2011; 75: 2305-2311.   80. Tamborero D, Mont L, Berruezo A, Matiello M, Benito B, Sitges M, Vidal B, de Caralt TM, Perea RJ, Vatasescu R, Brugada J. Left atrial posterior wall isolation does not improve the outcome of circumferential pulmonary vein ablation for atrial fibrillation: a prospective randomized study. Circ Arrhythm Electrophysiol 2009; 2: 35-40.   81. Di Biase L, Burkhardt JD, Mohanty P, Mohanty S, Sanchez JE, Trivedi C, Güneş M, Gökoğlan Y, Gianni C, Horton RP, Themistoclakis S, Gallinghouse GJ, Bailey S, Zagrodzky JD, Hongo RH, Beheiry S, Santangeli P, Casella M, Dello Russo A, Al-Ahmad A, Hranitzky P, Lakkireddy D, Tondo C, Natale A. Left Atrial Appendage Isolation in Patients With Long-standing Persistent AF Undergoing Catheter Ablation: BELIEF Trial. J Am Coll Cardiol 2016; 68: 1929-1940.   82. Di Biase L, Mohanty P, Mohanty S, Santangeli P, Trivedi C, Lakkireddy D, Reddy M, Jais P, Themistoclakis S, Dello Russo A, Casella M, Pelargonio G, Narducci ML, Schweikert R, Neuzil P, Sanchez J, Horton R, Beheiry S, Hongo R, Hao S, Rossillo A, Forleo G, Tondo C, Burkhardt JD, Haissaguerre M, Natale A. Ablation Versus Amiodarone for Treatment of Persistent Atrial Fibrillation in Patients With Congestive Heart Failure and an Implanted Device: Results From the AATAC Multicenter Randomized Trial. Circulation 2016; 133: 1637-1644.   83. Chen SA, Tai CT. Catheter ablation of atrial fibrillation originating from the non-pulmonary vein foci. J Cardiovasc Electrophysiol 2005; 16: 229-232.   84. Lee SH, Tai CT, Hsieh MH, Tsao HM, Lin YJ, Chang SL, Huang JL, Lee KT, Chen YJ, Cheng JJ, Chen SA. Predictors of non-pulmonary vein ectopic beats initiating paroxysmal atrial fibrillation: implication for catheter ablation. J Am Coll Cardiol 2005; 46: 1054-1059.   85. Hsieh MH, Chiou CW, Wen ZC, Wu CH, Tai CT, Tsai CF, Ding YA, Chang MS, Chen SA. Alterations of heart rate variability after radiofrequency catheter ablation of focal atrial fibrillation originating from pulmonary veins. Circulation 1999; 100: 2237-2243.   86. Di Biase L, Burkhardt JD, Mohanty P, Sanchez J, Horton R, Gallinghouse GJ, Lakkireddy D, Verma A, Khaykin Y, Hongo R, Hao S, Beheiry S, Pelargonio G, Dello Russo A, Casella M, Santarelli P, Santangeli P, Wang P, Al-Ahmad A, Patel D, Themistoclakis S, Bonso A, Rossillo A, Corrado A, Raviele A, Cummings JE, Schweikert RA, Lewis WR, Natale A. Periprocedural stroke and management of major bleeding complications in patients undergoing catheter ablation of atrial fibrillation: the impact of periprocedural therapeutic international normalized ratio. Circulation 2010; 121: 2550-2556.   87. Di Biase L, Burkhardt JD, Mohanty P, Sanchez J, Mohanty S, Horton R, Gallinghouse GJ, Bailey SM, Zagrodzky JD, Santangeli P, Hao S, Hongo R, Beheiry S, Themistoclakis S, Bonso A, Rossillo A, Corrado A, Raviele A, Al-Ahmad A, Wang P, Cummings JE, Schweikert RA, Pelargonio G, Dello Russo A, Casella M, Santarelli P, Lewis WR, Natale A. Left atrial appendage: an underrecognized trigger site of atrial fibrillation. Circulation 2010; 122: 109-118.   88. Santangeli P, Zado ES, Hutchinson MD, Riley MP, Lin D, Frankel DS, Supple GE, Garcia FC, Dixit S, Callans DJ, Marchlinski FE. Prevalence and distribution of focal triggers in persistent and long-standing persistent atrial fibrillation. Heart Rhythm 2016; 13: 374-382.   89. Sauer WH, Alonso C, Zado E, Cooper JM, Lin D, Dixit S, Russo A, Verdino R, Ji S, Gerstenfeld EP, Callans DJ, Marchlinski FE. Atrioventricular nodal reentrant tachycardia in patients referred for atrial fibrillation ablation: response to ablation that incorporates slow-pathway modification. Circulation 2006; 114: 191-195.   90. Lin WS, Tai CT, Hsieh MH, Tsai CF, Lin YK, Tsao HM, Huang JL, Yu WC, Yang SP, Ding YA, Chang MS, Chen SA. Catheter ablation of paroxysmal atrial fibrillation initiated by non-pulmonary vein ectopy. Circulation 2003; 107: 3176-3183.   91. Mohanty S. Outcomes of atrio-esophageal fistula following catheter ablation of atrial fibrillation treated with surgical repair versus esophageal stenting. J Cardiovasc Electrophysiol 2014; 25: E6.   92. Black-Maier E, Pokorney SD, Barnett AS, Zeitler EP, Sun AY, Jackson KP, Bahnson TD, Daubert JP, Piccini JP. Risk of atrioesophageal fistula formation with contact force-sensing catheters. Heart Rhythm 2017; 14: 1328-1333.   93. Lee RJ, Lakkireddy D, Mittal S, Ellis C, Connor JT, Saville BR, Wilber D. Percutaneous alternative to the Maze procedure for the treatment of persistent or long-standing persistent atrial fibrillation (aMAZE trial): Rationale and design. Am Heart J 2015; 170: 1184-1194.   94. Zhao Y, Di Biase L, Trivedi C, Mohanty S, Bai R, Mohanty P, Gianni C, Santangeli P, Horton R, Sanchez J, Gallinghouse GJ, Zagrodzky J, Hongo R, Beheiry S, Lakkireddy D, Reddy M, Hranitzky P, Al-Ahmad A, Elayi C, Burkhardt JD, Natale A. Importance of non-pulmonary vein triggers ablation to achieve long-term freedom from paroxysmal atrial fibrillation in patients with low ejection fraction. Heart Rhythm 2016; 13: 141-149.   95. Lee KN, Roh SY, Baek YS, Park HS, Ahn J, Kim DH, Lee DI, Shim J, Choi JI, Park SW, Kim YH. Long-Term Clinical Comparison of Procedural End Points After Pulmonary Vein Isolation in Paroxysmal Atrial Fibrillation: Elimination of Nonpulmonary Vein Triggers Versus Noninducibility. Circ Arrhythm Electrophysiol 2018; 11: e005019.   96. Dixit S, Marchlinski FE, Lin D, Callans DJ, Bala R, Riley MP, Garcia FC, Hutchinson MD, Ratcliffe SJ, Cooper JM, Verdino RJ, Patel VV, Zado ES, Cash NR, Killian T, Tomson TT, Gerstenfeld EP. Randomized ablation strategies for the treatment of persistent atrial fibrillation: RASTA study. Circ Arrhythm Electrophysiol 2012; 5: 287-294.   97. Dagres N, Bongiorni MG, Larsen TB, Hernandez-Madrid A, Pison L, Blomström-Lundqvist C; Scientific Initiatives Committee; European Heart Rhythm Association. Current ablation techniques for persistent atrial fibrillation: results of the European Heart Rhythm Association Survey. Europace 2015; 17: 1596-1600.   98. Hocini M, Shah AJ, Nault I, Sanders P, Wright M, Narayan SM, Takahashi Y, Jaïs P, Matsuo S, Knecht S, Sacher F, Lim KT, Clémenty J, Haïssaguerre M. Localized reentry within the left atrial appendage: arrhythmogenic role in patients undergoing ablation of persistent atrial fibrillation. Heart Rhythm 2011; 8: 1853-1861.    99. Panikker S, Virmani R, Sakakura K, Kolodgie F, Francis DP, Markides V, Walcott G, McElderry HT, Wong T. Left atrial appendage electrical isolation and concomitant device occlusion: A safety and feasibility study with histologic characterization. Heart Rhythm 2015; 12: 202-210.   100. Panikker S, Jarman JW, Virmani R, Kutys R, Haldar S, Lim E, Butcher C, Khan H, Mantziari L, Nicol E, Foran JP, Markides V, Wong T. Left Atrial Appendage Electrical Isolation and Concomitant Device Occlusion to Treat Persistent Atrial Fibrillation: A First-in-Human Safety, Feasibility, and Efficacy Study. Circ Arrhythm Electrophysiol 2016; 9.  101. Lakkireddy D, Reddy YM, Atkins D, Rajasingh J, Kanmanthareddy A, Olyaee M, Dusing R, Pimentel R, Bommana S, Dawn B. Effect of atrial fibrillation ablation on gastric motility: the atrial fibrillation gut study. Circ Arrhythm Electrophysiol 2015; 8: 531-536.   102. Rillig A, Tilz RR, Lin T, Fink T, Heeger CH, Arya A, Metzner A, Mathew S, Wissner E, Makimoto H, Wohlmuth P, Kuck KH, Ouyang F. Unexpectedly High Incidence of Stroke and Left Atrial Appendage Thrombus Formation After Electrical Isolation of the Left Atrial Appendage for the Treatment of Atrial Tachyarrhythmias. Circ Arrhythm Electrophysiol 2016; 9: e003461.   103. Nademanee K, Schwab MC, Kosar EM, Karwecki M, Moran MD, Visessook N, Michael AD, Ngarmukos T. Clinical outcomes of catheter substrate ablation for high-risk patients with atrial fibrillation. J Am Coll Cardiol 2008; 51: 843-849.   104. Park JH, Pak HN, Kim SK, Jang JK, Choi JI, Lim HE, Hwang C, Kim YH. Electrophysiologic characteristics of complex fractionated atrial electrograms in patients with atrial fibrillation. J Cardiovasc Electrophysiol 2009; 20: 266-272.   105. Haïssaguerre M, Hocini M, Sanders P, Takahashi Y, Rotter M, Sacher F, Rostock T, Hsu LF, Jonsson A, O'Neill MD, Bordachar P, Reuter S, Roudaut R, Clémenty J, Jaïs P. Localized sources maintaining atrial fibrillation organized by prior ablation. Circulation 2006; 113: 616-625.   106. Kim TH, Uhm JS, Kim JY, Joung B, Lee MH, Pak HN. Does Additional Electrogram-Guided Ablation After Linear Ablation Reduce Recurrence After Catheter Ablation for Long-standing Persistent Atrial Fibrillation? A Prospective Randomized Study. J Am Heart Assoc 2017; 6.
107. Ban JE, Chen YL, Park HC, Lee HS, Lee DI, Choi JI, Lim HE, Park SW, Kim YH. Relationship between complex fractionated atrial electrograms during atrial fibrillation and the critical site of atrial tachycardia that develops after catheter ablation for atrial fibrillation. J Cardiovasc Electrophysiol 2014; 25: 146-153.   108. Haïssaguerre M, Sanders P, Hocini M, Takahashi Y, Rotter M, Sacher F, Rostock T, Hsu LF, Bordachar P, Reuter S, Roudaut R, Clémenty J, Jaïs P. Catheter ablation of long-lasting persistent atrial fibrillation: critical structures for termination. J Cardiovasc Electrophysiol 2005; 16: 1125-1137.   109. Takahashi Y, O'Neill MD, Hocini M, Dubois R, Matsuo S, Knecht S, Mahapatra S, Lim KT, Jaïs P, Jonsson A, Sacher F, Sanders P, Rostock T, Bordachar P, Clémenty J, Klein GJ, Haïssaguerre M. Characterization of electrograms associated with termination of chronic atrial fibrillation by catheter ablation. J Am Coll Cardiol 2008; 51: 1003-1010.   110. Narayan SM, Wright M, Derval N, Jadidi A, Forclaz A, Nault I, Miyazaki S, Sacher F, Bordachar P, Clémenty J, Jaïs P, Haïssaguerre M, Hocini M. Classifying fractionated electrograms in human atrial fibrillation using monophasic action potentials and activation mapping: evidence for localized drivers, rate acceleration, and nonlocal signal etiologies. Heart Rhythm 2011; 8: 244-253.   111. Verma A, Sanders P, Macle L, Champagne J, Nair GM, Calkins H, Wilber DJ. Selective CFAE targeting for atrial fibrillation study (SELECT AF): clinical rationale, design, and implementation. J Cardiovasc Electrophysiol 2011; 22: 541-547.   112. Quintanilla JG, Pérez-Villacastín J, Pérez-Castellano N, Pandit SV, Berenfeld O, Jalife J, Filgueiras-Rama D. Mechanistic Approaches to Detect, Target, and Ablate the Drivers of Atrial Fibrillation. Circ Arrhythm Electrophysiol 2016; 9: e002481.    113. Verma A, Wazni OM, Marrouche NF, Martin DO, Kilicaslan F, Minor S, Schweikert RA, Saliba W, Cummings J, Burkhardt JD, Bhargava M, Belden WA, Abdul-Karim A, Natale A. Pre-existent left atrial scarring in patients undergoing pulmonary vein antrum isolation: an independent predictor of procedural failure. J Am Coll Cardiol 2005; 45: 285-292.   114. Kapa S, Desjardins B, Callans DJ, Marchlinski FE, Dixit S. Contact electroanatomic mapping derived voltage criteria for characterizing left atrial scar in patients undergoing ablation for atrial fibrillation. J Cardiovasc Electrophysiol 2014; 25: 1044-1052.   115. Oakes RS, Badger TJ, Kholmovski EG, Akoum N, Burgon NS, Fish EN, Blauer JJ, Rao SN, DiBella EV, Segerson NM, Daccarett M, Windfelder J, McGann CJ, Parker D, MacLeod RS, Marrouche NF. Detection and quantification of left atrial structural remodeling with delayed-enhancement magnetic resonance imaging in patients with atrial fibrillation. Circulation 2009; 119: 1758-1767.    116. McGann C, Akoum N, Patel A, Kholmovski E, Revelo P, Damal K, Wilson B, Cates J, Harrison A, Ranjan R, Burgon NS, Greene T, Kim D, Dibella EV, Parker D, Macleod RS, Marrouche NF. Atrial fibrillation ablation outcome is predicted by left atrial remodeling on MRI. Circ Arrhythm Electrophysiol 2014; 7: 23-30.   117. Marrouche NF, Wilber D, Hindricks G, Jais P, Akoum N, Marchlinski F, Kholmovski E, Burgon N, Hu N, Mont L, Deneke T, Duytschaever M, Neumann T, Mansour M, Mahnkopf C, Herweg B, Daoud E, Wissner E, Bansmann P, Brachmann J. Association of atrial tissue fibrosis identified by delayed enhancement MRI and atrial fibrillation catheter ablation: the DECAAF study. JAMA 2014; 311: 498-506.   118. Narayan SM, Baykaner T, Clopton P, Schricker A, Lalani GG, Krummen DE, Shivkumar K, Miller JM. Ablation of rotor and focal sources reduces late recurrence of atrial fibrillation compared with trigger ablation alone: extended follow-up of the CONFIRM trial (Conventional Ablation for Atrial Fibrillation With or Without Focal Impulse and Rotor Modulation). J Am Coll Cardiol 2014; 63: 1761-1768.    119. Narayan SM, Krummen DE, Shivkumar K, Clopton P, Rappel WJ, Miller JM. Treatment of atrial fibrillation by the ablation of localized sources: CONFIRM (Conventional Ablation for Atrial Fibrillation With or Without Focal Impulse and Rotor Modulation) trial. J Am Coll Cardiol 2012; 60: 628-636.    120. ianni C, Mohanty S, Di Biase L, Metz T, Trivedi C, Gökoğlan Y, Güneş MF, Bai R, Al-Ahmad A, Burkhardt JD, Gallinghouse GJ, Horton RP, Hranitzky PM, Sanchez JE, Halbfaß P, Müller P, Schade A, Deneke T, Tomassoni GF, Natale A. Acute and early outcomes of focal impulse and rotor modulation (FIRM)-guided rotors-only ablation in patients with nonparoxysmal atrial fibrillation. Heart Rhythm 2016; 13: 830-835.   121. Buch E, Share M, Tung R, Benharash P, Sharma P, Koneru J, Mandapati R, Ellenbogen KA, Shivkumar K. Long-term clinical outcomes of focal impulse and rotor modulation for treatment of atrial fibrillation: A multicenter experience. Heart Rhythm 2016; 13: 636-641.   122. Narayan SM, Zaman JA. Mechanistically based mapping of human cardiac fibrillation. J Physiol 2016; 594: 2399-2415.    123. Benharash P, Buch E, Frank P, Share M, Tung R, Shivkumar K, Mandapati R. Quantitative analysis of localized sources identified by focal impulse and rotor modulation mapping in atrial fibrillation. Circ Arrhythm Electrophysiol 2015; 8: 554-561.    124. Hwang M, Song JS, Lee YS, Li C, Shim EB, Pak HN. Electrophysiological Rotor Ablation in In-Silico Modeling of Atrial Fibrillation: Comparisons with Dominant Frequency, Shannon Entropy, and Phase Singularity. PLoS One 2016; 11: e0149695.    125. Po SS, Nakagawa H, Jackman WM. Localization of left atrial ganglionated plexi in patients with atrial fibrillation. J Cardiovasc Electrophysiol 2009; 20: 1186-1189.   126. Patterson E, Po SS, Scherlag BJ, Lazzara R. Triggered firing in pulmonary veins initiated by in vitro autonomic nerve stimulation. Heart Rhythm 2005; 2: 624-631.   127. Choi EK, Shen MJ, Han S, Kim D, Hwang S, Sayfo S, Piccirillo G, Frick K, Fishbein MC, Hwang C, Lin SF, Chen PS. Intrinsic cardiac nerve activity and paroxysmal atrial tachyarrhythmia in ambulatory dogs. Circulation 2010; 121: 2615-2623.    128. Nakagawa H, Scherlag BJ, Patterson E, Ikeda A, Lockwood D, Jackman WM. Pathophysiologic basis of autonomic ganglionated plexus ablation in patients with atrial fibrillation. Heart Rhythm 2009; 6: S26-34.   129. Bettoni M, Zimmermann M. Autonomic tone variations before the onset of paroxysmal atrial fibrillation. Circulation 2002; 105: 2753-2759.   130. Patterson E, Lazzara R, Szabo B, Liu H, Tang D, Li YH, Scherlag BJ, Po SS. Sodium-calcium exchange initiated by the Ca 2+ transient: an arrhythmia trigger within pulmonary veins. J Am Coll Cardiol 2006; 47: 1196-1206.   131. Lemola K, Chartier D, Yeh YH, Dubuc M, Cartier R, Armour A, Ting M, Sakabe M, Shiroshita-Takeshita A, Comtois P, Nattel S. Pulmonary vein region ablation in experimental vagal atrial fibrillation: role of pulmonary veins versus autonomic ganglia. Circulation 2008; 117: 470-407.   132. Nishida K, Datino T, Macle L, Nattel S. Atrial fibrillation ablation: translating basic mechanistic insights to the patient. J Am Coll Cardiol 2014; 64: 823-831.   133. Choi EK, Zhao Y, Everett THt, Chen PS. Ganglionated plexi as neuromodulation targets for atrial fibrillation. J Cardiovasc Electrophysiol 2017; 28: 1485-1491.    134. Hwang M, Lim B, Song JS, Yu HT, Ryu AJ, Lee YS, Joung B, Shim EB, Pak HN. Ganglionated plexi stimulation induces pulmonary vein triggers and promotes atrial arrhythmogenecity: In silico modeling study. PLoS One 2017; 12: e0172931.    135. Stavrakis S, Nakagawa H, Po SS, Scherlag BJ, Lazzara R, Jackman WM. The role of the autonomic ganglia in atrial fibrillation. JACC Clin Electrophysiol 2015; 1: 1-13.    136. Driessen AHG, Berger WR, Krul SPJ, van den Berg NWE, Neefs J, Piersma FR, Chan Pin Yin DRPP, de Jong JSSG, van Boven WP, de Groot JR. Ganglion Plexus Ablation in Advanced Atrial Fibrillation: The AFACT Study. J Am Coll Cardiol 2016; 68: 1155-1165.   137. Morillo CA, Klein GJ, Jones DL, Guiraudon CM. Chronic rapid atrial pacing. Structural, functional, and electrophysiological characteristics of a new model of sustained atrial fibrillation. Circulation 1995; 91: 1588-1595.   138. Gray RA, Pertsov AM, Jalife J. Spatial and temporal organization during cardiac fibrillation. Nature 1998; 392: 75-78.   139. Mansour M, Mandapati R, Berenfeld O, Chen J, Samie FH, Jalife J. Left-to-right gradient of atrial frequencies during acute atrial fibrillation in the isolated sheep heart. Circulation 2001; 103: 2631-2636.   140. Sanders P, Berenfeld O, Hocini M, Jaïs P, Vaidyanathan R, Hsu LF, Garrigue S, Takahashi Y, Rotter M, Sacher F, Scavée C, Ploutz-Snyder R, Jalife J, Haïssaguerre M. Spectral analysis identifies sites of high-frequency activity maintaining atrial fibrillation in humans. Circulation 2005; 112: 789-797.   141. Lazar S, Dixit S, Marchlinski FE, Callans DJ, Gerstenfeld EP. Presence of left-to-right atrial frequency gradient in paroxysmal but not persistent atrial fibrillation in humans. Circulation 2004; 110: 3181-3186.   142. Atienza F, Almendral J, Jalife J, Zlochiver S, Ploutz-Snyder R, Torrecilla EG, Arenal A, Kalifa J, Fernández-Avilés F, Berenfeld O. Real-time dominant frequency mapping and ablation of dominant frequency sites in atrial fibrillation with left-to-right frequency gradients predicts long-term maintenance of sinus rhythm. Heart Rhythm 2009; 6: 33-40.   143. Li C, Lim B, Hwang M, Song JS, Lee YS, Joung B, Pak HN. The Spatiotemporal Stability of Dominant Frequency Sites in In-Silico Modeling of 3-Dimensional Left Atrial Mapping of Atrial Fibrillation. PLoS One 2016; 11: e0160017.    144. Atienza F, Almendral J, Ormaetxe JM, Moya A, Martínez-Alday JD, Hernández-Madrid A, Castellanos E, Arribas F, Arias MÁ, Tercedor L, Peinado R, Arcocha MF, Ortiz M, Martínez-Alzamora N, Arenal A, Fernández-Avilés F, Jalife J; RADAR-AF Investigators. Comparison of radiofrequency catheter ablation of drivers and circumferential pulmonary vein isolation in atrial fibrillation: a noninferiority randomized multicenter RADARAF trial. J Am Coll Cardiol 2014; 64: 2455-2467.   145. Linz D, Mahfoud F, Schotten U, Ukena C, Neuberger HR, Wirth K, Böhm M. Renal sympathetic denervation suppresses postapneic blood pressure rises and atrial fibrillation in a model for sleep apnea. Hypertension 2012; 60: 172-178.   146. Zhou Q, Zhou X, TuEr-Hong ZL, Wang H, Yin T, Li Y, Zhang L, Lu Y, Xing Q, Zhang J, Yang Y, Tang B. Renal sympathetic denervation suppresses atrial fibrillation induced by acute atrial ischemia/infarction through inhibition of cardiac sympathetic activity. Int J Cardiol 2016; 203: 187-195.   147. Pokushalov E, Romanov A, Katritsis DG, Artyomenko S, Bayramova S, Losik D, Baranova V, Karaskov A, Steinberg J4. Renal denervation for improving outcomes of catheter ablation in patients with atrial fibrillation and hypertension: early experience. Heart Rhythm 2014; 11: 1131-1138.   148. Vollmann D, Sossalla S, Schroeter MR, Zabel M. Renal artery ablation instead of pulmonary vein ablation in a hypertensive patient with symptomatic, drug-resistant, persistent atrial fibrillation. Clin Res Cardiol 2013; 102: 315-318.   149. Bakris GL, Townsend RR, Flack JM, Brar S, Cohen SA, D'Agostino R, Kandzari DE, Katzen BT, Leon MB, Mauri L, Negoita M, O'Neill WW, Oparil S, Rocha-Singh K, Bhatt DL; SYMPLICITY HTN-3 Investigators. 12-month blood pressure results of catheter-based renal artery denervation for resistant hypertension: the SYMPLICITY HTN-3 trial. J Am Coll Cardiol 2015; 65: 1314-1321.   150. Pokushalov E, Romanov A, Elesin D, Bogachev-Prokophiev A, Losik D, Bairamova S, Karaskov A, Steinberg JS. Catheter versus surgical ablation of atrial fibrillation after a failed initial pulmonary vein isolation procedure: a randomized controlled trial. J Cardiovasc Electrophysiol 2013; 24: 1338-1343.   151. Pokushalov E, Romanov A, Katritsis DG, Artyomenko S, Shirokova N, Karaskov A, Mittal S, Steinberg JS. Ganglionated plexus ablation vs linear ablation in patients undergoing pulmonary vein isolation for persistent/long-standing persistent atrial fibrillation: a randomized comparison. Heart Rhythm 2013; 10: 1280-1286.   152. Boersma LV, Castella M, van Boven W, Berruezo A, Yilmaz A, Nadal M, Sandoval E, Calvo N, Brugada J, Kelder J, Wijffels M, Mont L. Atrial fibrillation catheter ablation versus surgical ablation treatment (FAST): a 2-center randomized clinical trial. Circulation 2012; 125: 23-30.   153. Phan K, Phan S, Thiagalingam A, Medi C, Yan TD. Thoracoscopic surgical ablation versus catheter ablation for atrial fibrillation. Eur J Cardiothorac Surg 2016; 49: 1044-1051.   154. Pison L, La Meir M, van Opstal J, Blaauw Y, Maessen J, Crijns HJ. Hybrid thoracoscopic surgical and transvenous catheter ablation of atrial fibrillation. J Am Coll Cardiol 2012; 60: 54-61.   155. Gehi AK, Mounsey JP, Pursell I, Landers M, Boyce K, Chung EH, Schwartz J, Walker TJ, Guise K, Kiser AC. Hybrid epicardial-endocardial ablation using a pericardioscopic technique for the treatment of atrial fibrillation. Heart Rhythm 2013; 10: 22-28.   156. Geršak B, Zembala MO, Müller D, Folliguet T, Jan M, Kowalski O, Erler S, Bars C, Robic B, Filipiak K, Wimmer-Greinecker G. European experience of the convergent atrial fibrillation procedure: multicenter outcomes in consecutive patients. J Thorac Cardiovasc Surg 2014; 147: 1411-1416.   157. Bulava A, Mokracek A, Hanis J, Kurfirst V, Eisenberger M, Pesl L. Sequential hybrid procedure for persistent atrial fibrillation. J Am Heart Assoc 2015; 4: e001754.    158. Raitt MH, Kusumoto W, Giraud G, McAnulty JH. Reversal of electrical remodeling after cardioversion of persistent atrial fibrillation. J Cardiovasc Electrophysiol 2004; 15: 507-512.   159. Igarashi M, Tada H, Sekiguchi Y, Yamasaki H, Arimoto T, Kuroki K, Machino T, Murakoshi N, Aonuma K. Effect of restoration of sinus rhythm by extensive antiarrhythmic drugs in predicting results of catheter ablation of persistent atrial fibrillation. Am J Cardiol 2010; 106: 62-68.   160. Rivard L, Hocini M, Rostock T, Cauchemez B, Forclaz A, Jadidi AS, Linton N, Nault I, Miyazaki S, Liu X, Xhaet O, Shah A, Sacher F, Derval N, Jaïs P, Khairy P, Macle L, Nattel S, Willems S, Haïssaguerre M. Improved outcome following restoration of sinus rhythm prior to catheter ablation of persistent atrial fibrillation: a comparative multicenter study. Heart Rhythm 2012; 9: 1025-1030.   161. Mohanty S, Di Biase L, Mohanty P, Trivedi C, Santangeli P, Bai R, Burkhardt JD, Gallinghouse JG, Horton R, Sanchez JE, Hranitzky PM, Zagrodzky J, Al-Ahmad A, Pelargonio G, Lakkireddy D, Reddy M, Forleo G, Rossillo A, Themistoclakis S, Hongo R, Beheiry S, Casella M, Dello Russo A, Tondo C, Natale A. Effect of periprocedural amiodarone on procedure outcome in patients with long-standing persistent atrial fibrillation undergoing extended pulmonary vein antrum isolation: results from a randomized study (SPECULATE). Heart Rhythm 2015; 12: 477-483.   162. Dublin S, French B, Glazer NL, Wiggins KL, Lumley T, Psaty BM, Smith NL, Heckbert SR. Risk of new-onset atrial fibrillation in relation to body mass index. Arch Intern Med 2006; 166: 2322-2328.   163. Tedrow UB, Conen D, Ridker PM, Cook NR, Koplan BA, Manson JE, Buring JE, Albert CM. The long- and short-term impact of elevated body mass index on the risk of new atrial fibrillation the WHS (women's health study). J Am Coll Cardiol 2010; 55: 2319-2327.    164. Munger TM, Dong YX, Masaki M, Oh JK, Mankad SV, Borlaug BA, Asirvatham SJ, Shen WK, Lee HC, Bielinski SJ, Hodge DO, Herges RM, Buescher TL, Wu JH, Ma C, Zhang Y, Chen PS, Packer DL, Cha YM. Electrophysiological and hemodynamic characteristics associated with obesity in patients with atrial fibrillation. J Am Coll Cardiol 2012; 60: 851-860.   165. Gami AS, Hodge DO, Herges RM, Olson EJ, Nykodym J, Kara T, Somers VK. Obstructive sleep apnea, obesity, and the risk of incident atrial fibrillation. J Am Coll Cardiol 2007; 49: 565-571.   166. Jongnarangsin K, Chugh A, Good E, Mukerji S, Dey S, Crawford T, Sarrazin JF, Kuhne M, Chalfoun N, Wells D, Boonyapisit W, Pelosi F, Jr., Bogun F, Morady F, Oral H. Body mass index, obstructive sleep apnea, and outcomes of catheter ablation of atrial fibrillation. J Cardiovasc Electrophysiol 2008; 19: 668-672.   167. Gerstenfeld EP, Callans DJ, Dixit S, Russo AM, Nayak H, Lin D, Pulliam W, Siddique S, Marchlinski FE. Mechanisms of organized left atrial tachycardias occurring after pulmonary vein isolation. Circulation 2004; 110: 1351-1357.   168. Chugh A, Oral H, Good E, Han J, Tamirisa K, Lemola K, Elmouchi D, Tschopp D, Reich S, Igic P, Bogun F, Pelosi F, Jr., Morady F. Catheter ablation of atypical atrial flutter and atrial tachycardia within the coronary sinus after left atrial ablation for atrial fibrillation. J Am Coll Cardiol 2005; 46: 83-91.   169. Chugh A, Oral H, Lemola K, Hall B, Cheung P, Good E, Tamirisa K, Han J, Bogun F, Pelosi F, Jr., Morady F. Prevalence, mechanisms, and clinical significance of macroreentrant atrial tachycardia during and following left atrial ablation for atrial fibrillation. Heart Rhythm 2005; 2: 464-471.   170. Kuck KH, Brugada J, Fürnkranz A, Metzner A, Ouyang F, Chun KR, Elvan A, Arentz T, Bestehorn K, Pocock SJ, Albenque JP, Tondo C; FIRE AND ICE Investigators. Cryoballoon or Radiofrequency Ablation for Paroxysmal Atrial Fibrillation. N Engl J Med 2016; 374: 2235-2245.   171. Mesas CE, Pappone C, Lang CC, Gugliotta F, Tomita T, Vicedomini G, Sala S, Paglino G, Gulletta S, Ferro A, Santinelli V. Left atrial tachycardia after circumferential pulmonary vein ablation for atrial fibrillation: electroanatomic characterization and treatment. J Am Coll Cardiol 2004; 44: 1071-1079.   172. Anter E, McElderry TH, Contreras-Valdes FM, Li J, Tung P, Leshem E, Haffajee CI, Nakagawa H, Josephson ME. Evaluation of a novel high-resolution mapping technology for ablation of recurrent scar-related atrial tachycardias. Heart Rhythm 2016; 13: 2048-2055.   173. Shah D, Sunthorn H, Burri H, Gentil-Baron P, Pruvot E, Schlaepfer J, Fromer M. Narrow, slow-conducting isthmus dependent left atrial reentry developing after ablation for atrial fibrillation: ECG characterization and elimination by focal RF ablation. J Cardiovasc Electrophysiol 2006; 17: 508-515.   174. Chugh A, Latchamsetty R, Oral H, Elmouchi D, Tschopp D, Reich S, Igic P, Lemerand T, Good E, Bogun F, Pelosi F, Jr., Morady F. Characteristics of cavotricuspid isthmus-dependent atrial flutter after left atrial ablation of atrial fibrillation. Circulation 2006; 113: 609-615.   175. Anter E, Tschabrunn CM, Contreras-Valdes FM, Li J, Josephson ME. Pulmonary vein isolation using the Rhythmia mapping system: Verification of intracardiac signals using the Orion mini-basket catheter. Heart Rhythm 2015; 12: 1927-1934.   176. Di Biase L, Conti S, Mohanty P, Bai R, Sanchez J, Walton D, John A, Santangeli P, Elayi CS, Beheiry S, Gallinghouse GJ, Mohanty S, Horton R, Bailey S, Burkhardt JD, Natale A. General anesthesia reduces the prevalence of pulmonary vein reconnection during repeat ablation when compared with conscious sedation: results from a randomized study. Heart Rhythm 2011; 8: 368-372.   177. Hutchinson MD, Garcia FC, Mandel JE, Elkassabany N, Zado ES, Riley MP, Cooper JM, Bala R, Frankel DS, Lin D, Supple GE, Dixit S, Gerstenfeld EP, Callans DJ, Marchlinski FE. Efforts to enhance catheter stability improve atrial fibrillation ablation outcome. Heart Rhythm 2013; 10: 347-353.   178. Di Biase L, Saenz LC, Burkhardt DJ, Vacca M, Elayi CS, Barrett CD, Horton R, Bai R, Siu A, Fahmy TS, Patel D, Armaganijan L, Wu CT, Kai S, Ching CK, Phillips K, Schweikert RA, Cummings JE, Arruda M, Saliba WI, Dodig M, Natale A. Esophageal capsule endoscopy after radiofrequency catheter ablation for atrial fibrillation: documented higher risk of luminal esophageal damage with general anesthesia as compared with conscious sedation. Circ Arrhythm Electrophysiol 2009; 2: 108-112.   179. Martinek M, Bencsik G, Aichinger J, Hassanein S, Schoefl R, Kuchinka P, Nesser HJ, Purerfellner H. Esophageal damage during radiofrequency ablation of atrial fibrillation: impact of energy settings, lesion sets, and esophageal visualization. J Cardiovasc Electrophysiol 2009; 20: 726-733.   180. Martinek M, Hassanein S, Bencsik G, Aichinger J, Schoefl R, Bachl A, Gerstl S, Nesser HJ, Purerfellner H. Acute development of gastroesophageal reflux after radiofrequency catheter ablation of atrial fibrillation. Heart Rhythm 2009; 6: 1457-1462.   181. S Sadek MM, Maeda S, Chik W, Santangeli P, Zado ES, Schaller RD, Supple GE, Frankel DS, Hutchinson MD, Garcia FC, Riley MP, Lin D, Dixit S, Callans DJ, Marchlinski FE. Recurrent atrial arrhythmias in the setting of chronic pulmonary vein isolation. Heart Rhythm 2016; 13: 2174-180.   182. Santangeli P, Di Biase L, Al-Ahmad A, Horton R, Burkhardt JD, Sanchez JE, Bai R, Pump A, Mohanty S, Natale A. Ablation for Atrial Fibrillation: Termination of Atrial Fibrillation is Not the End Point. Card Electrophysiol Clin 2012; 4: 343-352.   183. Santangeli P, Di Biase L, Horton R, Burkhardt JD, Sanchez J, Al-Ahmad A, Hongo R, Beheiry S, Bai R, Mohanty P, Lewis WR, Natale A. Ablation of atrial fibrillation under therapeutic warfarin reduces periprocedural complications: evidence from a meta-analysis. Circ Arrhythm Electrophysiol 2012; 5: 302-311.   184. Santangeli P, Di Biase L, Mohanty P, Burkhardt JD, Horton R, Bai R, Mohanty S, Pump A, Gibson D, Couts L, Hongo R, Beheiry S, Natale A. Catheter ablation of atrial fibrillation in octogenarians: safety and outcomes. J Cardiovasc Electrophysiol 2012; 23: 687-693.   185. Elayi CS, Di Biase L, Barrett C, Ching CK, al Aly M, Lucciola M, Bai R, Horton R, Fahmy TS, Verma A, Khaykin Y, Shah J, Morales G, Hongo R, Hao S, Beheiry S, Arruda M, Schweikert RA, Cummings J, Burkhardt JD, Wang P, Al-Ahmad A, Cauchemez B, Gaita F, Natale A. Atrial fibrillation termination as a procedural endpoint during ablation in long-standing persistent atrial fibrillation. Heart Rhythm 2010; 7: 1216-1223.   186. Lim HS, Derval N, Komatsu Y, Zellerhoff S, Denis A, Shah AJ, Sacher F, Hocini M, Jaïs P, Haïssaguerre M. Is ablation to termination the best strategy for ablation of persistent atrial fibrillation? Persistent atrial fibrillation is best ablated by a strategy that terminates the arrhythmia: procedural termination is associated with improved long-term outcomes. Circ Arrhythm Electrophysiol 2015; 8: 963-971.   187. Kochhäuser S, Jiang CY, Betts TR, Chen J, Deisenhofer I, Mantovan R, Macle L, Morillo CA, Haverkamp W, Weerasooriya R, Albenque JP, Nardi S, Menardi E, Novak P, Sanders P, Verma A; STAR AF II Investigators. Impact of acute atrial fibrillation termination and prolongation of atrial fibrillation cycle length on the outcome of ablation of persistent atrial fibrillation: A substudy of the STAR AF II trial. Heart Rhythm 2017; 14: 476-483.   188. Scott PA, Silberbauer J, Murgatroyd FD. The impact of adjunctive complex fractionated atrial electrogram ablation and linear lesions on outcomes in persistent atrial fibrillation: a meta-analysis. Europace 2016; 18: 359-367.   189. Kottkamp H, Berg J, Bender R, Rieger A, Schreiber D. Box Isolation of Fibrotic Areas (BIFA): A Patient-Tailored Substrate Modification Approach for Ablation of Atrial Fibrillation. J Cardiovasc Electrophysiol 2016; 27: 22-30.   190. Zaman JA, Peters NS, Narayan SM. Rotor mapping and ablation to treat atrial fibrillation. Curr Opin Cardiol 2015; 30: 24-32.    191. Bai R, Di Biase L, Mohanty P, Dello Russo A, Casella M, Pelargonio G, Themistoclakis S, Mohanty S, Elayi CS, Sanchez J, Burkhardt JD, Horton R, Gallinghouse GJ, Bailey SM, Bonso A, Beheiry S, Hongo RH, Raviele A, Tondo C, Natale A. Ablation of perimitral flutter following catheter ablation of atrial fibrillation: impact on outcomes from a randomized study (PROPOSE). J Cardiovasc Electrophysiol 2012; 23: 137-144.   192. Bai R, DI Biase L, Valderrabano M, Lorgat F, Mlcochova H, Tilz R, Meyerfeldt U, Hranitzky PM, Wazni O, Kanagaratnam P, Doshi RN, Gibson D, Pisapia A, Mohanty P, Saliba W, Ouyang F, Kautzner J, Gallinghouse GJ, Natale A. Worldwide experience with the robotic navigation system in catheter ablation of atrial fibrillation: methodology, efficacy and safety. J Cardiovasc Electrophysiol 2012; 23: 820-826.   193. Di Biase L, Fahmy TS, Wazni OM, Bai R, Patel D, Lakkireddy D, Cummings JE, Schweikert RA, Burkhardt JD, Elayi CS, Kanj M, Popova L, Prasad S, Martin DO, Prieto L, Saliba W, Tchou P, Arruda M, Natale A. Pulmonary vein total occlusion following catheter ablation for atrial fibrillation: clinical implications after long-term follow-up. J Am Coll Cardiol 2006; 48: 2493-2499.   1. Boersma LV, Wijffels MC, Oral H, Wever EF, Morady F. Pulmonary vein isolation by duty-cycled bipolar and unipolar radiofrequency energy with a multielectrode ablation catheter. Heart Rhythm 2008; 5: 1635-1642.   2. Jais P, Haissaguerre M, Shah DC, Takahashi A, Hocini M, Lavergne T, Lafitte S, Le Mouroux A, Fischer B, Clementy J. Successful irrigated-tip catheter ablation of atrial flutter resistant to conventional radiofrequency ablation. Circulation 1998; 98: 835-838.   3. Haines DE, Strunk AR, Novichenok A, Kirchhof N, Stewart M. The Biophysics of Passive Convective Cooling During Catheter Ablation with Gold versus Platinum Electrodes and Multielectrode Phased Radiofrequency Energy Delivery. J Cardiovasc Electrophysiol 2015; 26: 1257-1261.   4. Nakagawa H, Yamanashi WS, Pitha JV, Arruda M, Wang X, Ohtomo K, Beckman KJ, McClelland JH, Lazzara R, Jackman WM. Comparison of in vivo tissue temperature profile and lesion geometry for radiofrequency ablation with a saline-irrigated electrode versus temperature control in a canine thigh muscle preparation. Circulation 1995; 91: 2264-2273.   5. Hwang ES, Pak HN, Park SW, Park JS, Joung B, Choi D, Lee MH, Kim YH. Risks and benefits of an open irrigation tip catheter in intensive radiofrequency catheter ablation in patients with non-paroxysmal atrial fibrillation. Circ J 2010; 74: 644-649.   6. Reddy VY, Dukkipati SR, Neuzil P, Natale A, Albenque JP, Kautzner J, Shah D, Michaud G, Wharton M, Harari D, Mahapatra S, Lambert H, Mansour M. Randomized, Controlled Trial of the Safety and Effectiveness of a Contact Force-Sensing Irrigated Catheter for Ablation of Paroxysmal Atrial Fibrillation: Results of the TactiCath Contact Force Ablation Catheter Study for Atrial Fibrillation (TOCCASTAR) Study. Circulation 2015; 132: 907-915.   7. Finta B, Haines DE. Catheter ablation therapy for atrial fibrillation. Cardiol Clin 2004; 22: 127-145.   8. Thomas SP, Aggarwal G, Boyd AC, Jin Y, Ross DL. A comparison of open irrigated and non-irrigated tip catheter ablation for pulmonary vein isolation. Europace 2004; 6: 330-335.   9. Bruce GK, Bunch TJ, Milton MA, Sarabanda A, Johnson SB, Packer DL. Discrepancies between catheter tip and tissue temperature in cooled-tip ablation: relevance to guiding left atrial ablation. Circulation 2005; 112: 954-960.   10. Oh S, Kilicaslan F, Zhang Y, Wazni O, Mazgalev TN, Natale A, Marrouche NF. Avoiding microbubbles formation during radiofrequency left atrial ablation versus continuous microbubbles formation and standard radiofrequency ablation protocols: comparison of energy profiles and chronic lesion characteristics. J Cardiovasc Electrophysiol 2006; 17: 72-77.   11. Tanno K, Kobayashi Y, Kurano K, Kikushima S, Yazawa T, Baba T, Inoue S, Mukai H, Katagiri T. Histopathology of canine hearts subjected to catheter ablation using radiofrequency energy. Jpn Circ J 1994; 58: 123-135.   12. Nath S, Lynch C, 3rd., Whayne JG, Haines DE. Cellular electrophysiological effects of hyperthermia on isolated guinea pig papillary muscle. Implications for catheter ablation. Circulation 1993; 88: 1826-1831.   13. Everett THt, Nath S, Lynch C, 3rd., Beach JM, Whayne JG, Haines DE. Role of calcium in acute hyperthermic myocardial injury. J Cardiovasc Electrophysiol 2001; 12: 563-569.   14. Tritto M, De Ponti R, Salerno-Uriarte JA, Spadacini G, Marazzi R, Moretti P, Lanzotti M. Adenosine restores atrio-venous conduction after apparently successful ostial isolation of the pulmonary veins. Eur Heart J 2004; 25: 2155-2163.   15. Saad EB, Rossillo A, Saad CP, Martin DO, Bhargava M, Erciyes D, Bash D, Williams-Andrews M, Beheiry S, Marrouche NF, Adams J, Pisano E, Fanelli R, Potenza D, Raviele A, Bonso A, Themistoclakis S, Brachmann J, Saliba WI, Schweikert RA, Natale A. Pulmonary vein stenosis after radiofrequency ablation of atrial fibrillation: functional characterization, evolution, and influence of the ablation strategy. Circulation 2003; 108: 3102-3107.   16. Di Biase L, Natale A, Barrett C, Tan C, Elayi CS, Ching CK, Wang P, Al-Ahmad A, Arruda M, Burkhardt JD, Wisnoskey BJ, Chowdhury P, De Marco S, Armaganijan L, Litwak KN, Schweikert RA, Cummings JE. Relationship between catheter forces, lesion characteristics, "popping," and char formation: experience with robotic navigation system. J Cardiovasc Electrophysiol 2009; 20: 436-440.   17. Avitall B, Mughal K, Hare J, Helms R, Krum D. The effects of electrode-tissue contact on radiofrequency lesion generation. Pacing Clin Electrophysiol 1997; 20: 2899-2910.   18. Yokoyama K, Nakagawa H, Shah DC, Lambert H, Leo G, Aeby N, Ikeda A, Pitha JV, Sharma T, Lazzara R, Jackman WM. Novel contact force sensor incorporated in irrigated radiofrequency ablation catheter predicts lesion size and incidence of steam pop and thrombus. Circ Arrhythm Electrophysiol 2008; 1: 354-362.   19. Ikeda A, Nakagawa H, Lambert H, Shah DC, Fonck E, Yulzari A, Sharma T, Pitha JV, Lazzara R, Jackman WM. Relationship between catheter contact force and radiofrequency lesion size and incidence of steam pop in the beating canine heart: electrogram amplitude, impedance, and electrode temperature are poor predictors of electrode-tissue contact force and lesion size. Circ Arrhythm Electrophysiol 2014; 7: 1174-1180.   20. Nakagawa H, Kautzner J, Natale A, Peichl P, Cihak R, Wichterle D, Ikeda A, Santangeli P, Di Biase L, Jackman WM. Locations of high contact force during left atrial mapping in atrial fibrillation patients: electrogram amplitude and impedance are poor predictors of electrode-tissue contact force for ablation of atrial fibrillation. Circ Arrhythm Electrophysiol 2013; 6: 746-753.   21. Natale A, Reddy VY, Monir G, Wilber DJ, Lindsay BD, McElderry HT, Kantipudi C, Mansour MC, Melby DP, Packer DL, Nakagawa H, Zhang B, Stagg RB, Boo LM, Marchlinski FE. Paroxysmal AF catheter ablation with a contact force sensing catheter: results of the prospective, multicenter SMART-AF trial. J Am Coll Cardiol 2014; 64: 647-656.   22. Kumar S, Haqqani HM, Chan M, Lee J, Yudi M, Wong MC, Morton JB, Ling LH, Robinson T, Heck PM, Kelland NF, Halloran K, Spence SJ, Kistler PM, Kalman JM. Predictive value of impedance changes for real-time contact force measurements during catheter ablation of atrial arrhythmias in humans. Heart Rhythm 2013; 10: 962-929.   23. Kumar S, Morton JB, Lee J, Halloran K, Spence SJ, Gorelik A, Hepworth G, Kistler PM, Kalman JM. Prospective characterization of catheter-tissue contact force at different anatomic sites during antral pulmonary vein isolation. Circ Arrhythm Electrophysiol 2012; 5: 1124-1129.   24. Haldar S, Jarman JW, Panikker S, Jones DG, Salukhe T, Gupta D, Wynn G, Hussain W, Markides V, Wong T. Contact force sensing technology identifies sites of inadequate contact and reduces acute pulmonary vein reconnection: a prospective case control study. Int J Cardiol 2013; 168: 1160-1166.   25. Reddy VY, Shah D, Kautzner J, Schmidt B, Saoudi N, Herrera C, Jais P, Hindricks G, Peichl P, Yulzari A, Lambert H, Neuzil P, Natale A, Kuck KH. The relationship between contact force and clinical outcome during radiofrequency catheter ablation of atrial fibrillation in the TOCCATA study. Heart Rhythm 2012; 9: 1789-1795.   26. Perna F, Heist EK, Danik SB, Barrett CD, Ruskin JN, Mansour M. Assessment of catheter tip contact force resulting in cardiac perforation in swine atria using force sensing technology. Circ Arrhythm Electrophysiol 2011; 4: 218-224.   27. Andrade JG, Monir G, Pollak SJ, Khairy P, Dubuc M, Roy D, Talajic M, Deyell M, Rivard L, Thibault B, Guerra PG, Nattel S, Macle L. Pulmonary vein isolation using "contact force" ablation: the effect on dormant conduction and long-term freedom from recurrent atrial fibrillation--a prospective study. Heart Rhythm 2014; 11: 1919-1924.   28. Wilber DJ, Pappone C, Neuzil P, De Paola A, Marchlinski F, Natale A, Macle L, Daoud EG, Calkins H, Hall B, Reddy V, Augello G, Reynolds MR, Vinekar C, Liu CY, Berry SM, Berry DA, ThermoCool AFTI. Comparison of antiarrhythmic drug therapy and radiofrequency catheter ablation in patients with paroxysmal atrial fibrillation: a randomized controlled trial. JAMA 2010; 303: 333-340.   29. Ullah W, McLean A, Tayebjee MH, Gupta D, Ginks MR, Haywood GA, O'Neill M, Lambiase PD, Earley MJ, Schilling RJ, Group UKMT. Randomized trial comparing pulmonary vein isolation using the SmartTouch catheter with or without real-time contact force data. Heart Rhythm 2016; 13: 1761-1767.   30. Neuzil P, Reddy VY, Kautzner J, Petru J, Wichterle D, Shah D, Lambert H, Yulzari A, Wissner E, Kuck KH. Electrical reconnection after pulmonary vein isolation is contingent on contact force during initial treatment: results from the EFFICAS I study. Circ Arrhythm Electrophysiol 2013; 6: 327-333.   31. Sohns C, Karim R, Harrison J, Arujuna A, Linton N, Sennett R, Lambert H, Leo G, Williams S, Razavi R, Wright M, Schaeffter T, O'Neill M, Rhode K. Quantitative magnetic resonance imaging analysis of the relationship between contact force and left atrial scar formation after catheter ablation of atrial fibrillation. J Cardiovasc Electrophysiol 2014; 25: 138-145.   32. Wakili R, Clauss S, Schmidt V, Ulbrich M, Hahnefeld A, Schussler F, Siebermair J, Kaab S, Estner HL. Impact of real-time contact force and impedance measurement in pulmonary vein isolation procedures for treatment of atrial fibrillation. Clin Res Cardiol 2014; 103: 97-106.   33. Raatikainen MJ, Hakalahti A, Uusimaa P, Nielsen JC, Johannessen A, Hindricks G, Walfridsson H, Pehrson S, Englund A, Hartikainen J, Kongstad O, Mortensen LS, Hansen PS, investigators M-P. Radiofrequency catheter ablation maintains its efficacy better than antiarrhythmic medication in patients with paroxysmal atrial fibrillation: On-treatment analysis of the randomized controlled MANTRA-PAF trial. Int J Cardiol 2015; 198: 108-114.   34. Jin ES, Wang PJ. Cryoballoon Ablation for Atrial Fibrillation: a Comprehensive Review and Practice Guide. Korean Circ J 2018; 48: 114-123.    35. Van Belle Y, Janse P, Rivero-Ayerza MJ, Thornton AS, Jessurun ER, Theuns D, Jordaens L. Pulmonary vein isolation using an occluding cryoballoon for circumferential ablation: feasibility, complications, and short-term outcome. Eur Heart J 2007; 28: 2231-2237.   36. Packer DL, Kowal RC, Wheelan KR, Irwin JM, Champagne J, Guerra PG, Dubuc M, Reddy V, Nelson L, Holcomb RG, Lehmann JW, Ruskin JN; Investigators SAC. Cryoballoon ablation of pulmonary veins for paroxysmal atrial fibrillation: first results of the North American Arctic Front (STOP AF) pivotal trial. J Am Coll Cardiol 2013; 61: 1713-1723.   37. Reddy VY, Sediva L, Petru J, Skoda J, Chovanec M, Chitovova Z, Di Stefano P, Rubin E, Dukkipati S, Neuzil P. Durability of Pulmonary Vein Isolation with Cryoballoon Ablation: Results from the Sustained PV Isolation with Arctic Front Advance (SUPIR) Study. J Cardiovasc Electrophysiol 2015; 26: 493-500.   38. Andrade JG, Pollak SJ, Monir G, Khairy P, Dubuc M, Roy D, Talajic M, Deyell M, Rivard L, Thibault B, Guerra PG, Nattel S, Macle L. Pulmonary vein isolation using a pace-capture-guided versus an adenosine-guided approach: effect on dormant conduction and long-term freedom from recurrent atrial fibrillation--a prospective study. Circ Arrhythm Electrophysiol 2013; 6: 1103-1108.   39. Furnkranz A, Bordignon S, Schmidt B, Gunawardene M, Schulte-Hahn B, Urban V, Bode F, Nowak B, Chun JK. Improved procedural efficacy of pulmonary vein isolation using the novel second-generation cryoballoon. J Cardiovasc Electrophysiol 2013; 24: 492-497.   40. Coulombe N, Paulin J, Su W. Improved in vivo performance of second-generation cryoballoon for pulmonary vein isolation. J Cardiovasc Electrophysiol 2013; 24: 919-925.   41. Schmidt M, Dorwarth U, Andresen D, Brachmann J, Kuck KH, Kuniss M, Lewalter T, Spitzer S, Willems S, Senges J, Junger C, Hoffmann E. Cryoballoon versus RF ablation in paroxysmal atrial fibrillation: results from the German Ablation Registry. J Cardiovasc Electrophysiol 2014; 25: 1-7.   42. Andrade JG, Khairy P, Guerra PG, Deyell MW, Rivard L, Macle L, Thibault B, Talajic M, Roy D, Dubuc M. Efficacy and safety of cryoballoon ablation for atrial fibrillation: a systematic review of published studies. Heart Rhythm 2011; 8: 1444-1451.   43. Linhart M, Bellmann B, Mittmann-Braun E, Schrickel JW, Bitzen A, Andrie R, Yang A, Nickenig G, Lickfett L, Lewalter T. Comparison of cryoballoon and radiofrequency ablation of pulmonary veins in 40 patients with paroxysmal atrial fibrillation: a case-control study. J Cardiovasc Electrophysiol 2009; 20: 1343-1348.   44. Aryana A, Singh SM, Kowalski M, Pujara DK, Cohen AI, Singh SK, Aleong RG, Banker RS, Fuenzalida CE, Prager NA, Bowers MR, D'Avila A, O'Neill PG. Acute and Long-Term Outcomes of Catheter Ablation of Atrial Fibrillation Using the Second-Generation Cryoballoon versus Open-Irrigated Radiofrequency: A Multicenter Experience. J Cardiovasc Electrophysiol 2015; 26: 832-839.   45. Kuck KH, Furnkranz A, Chun KR, Metzner A, Ouyang F, Schluter M, Elvan A, Lim HW, Kueffer FJ, Arentz T, Albenque JP, Tondo C, Kuhne M, Sticherling C, Brugada J; Fire and Investigators ICE. Cryoballoon or radiofrequency ablation for symptomatic paroxysmal atrial fibrillation: reintervention, rehospitalization, and quality-of-life outcomes in the FIRE AND ICE trial. Eur Heart J 2016; 37: 2858-2865.    46. Dukkipati SR, Kuck KH, Neuzil P, Woollett I, Kautzner J, McElderry HT, Schmidt B, Gerstenfeld EP, Doshi SK, Horton R, Metzner A, d'Avila A, Ruskin JN, Natale A, Reddy VY. Pulmonary vein isolation using a visually guided laser balloon catheter: the first 200-patient multicenter clinical experience. Circ Arrhythm Electrophysiol 2013; 6: 467-472.   47. Dukkipati SR, Neuzil P, Skoda J, Petru J, d'Avila A, Doshi SK, Reddy VY. Visual balloon-guided point-by-point ablation: reliable, reproducible, and persistent pulmonary vein isolation. Circ Arrhythm Electrophysiol 2010; 3: 266-273.   48. Chae S, Oral H, Good E, Dey S, Wimmer A, Crawford T, Wells D, Sarrazin JF, Chalfoun N, Kuhne M, Fortino J, Huether E, Lemerand T, Pelosi F, Bogun F, Morady F, Chugh A. Atrial tachycardia after circumferential pulmonary vein ablation of atrial fibrillation: mechanistic insights, results of catheter ablation, and risk factors for recurrence. J Am Coll Cardiol 2007; 50: 1781-1787.   49. Bordignon S, Chun KR, Gunawardene M, Urban V, Kulikoglu M, Miehm K, Brzank B, Schulte-Hahn B, Nowak B, Schmidt B. Energy titration strategies with the endoscopic ablation system: lessons from the high-dose vs. low-dose laser ablation study. Europace 2013; 15: 685-689.   50. Dukkipati SR, Cuoco F, Kutinsky I, Aryana A, Bahnson TD, Lakkireddy D, Woollett I, Issa ZF, Natale A, Reddy VY; HeartLight Study I. Pulmonary Vein Isolation Using the Visually Guided Laser Balloon: A Prospective, Multicenter, and Randomized Comparison to Standard Radiofrequency Ablation. J Am Coll Cardiol 2015; 66: 1350-1360.   51. Bordignon S, Chun KR, Gunawardene M, Fuernkranz A, Urban V, Schulte-Hahn B, Nowak B, Schmidt B. Comparison of balloon catheter ablation technologies for pulmonary vein isolation: the laser versus cryo study. J Cardiovasc Electrophysiol 2013; 24: 987-994.   52. Steinwender C, Honig S, Leisch F, Hofmann R. Acute results of pulmonary vein isolation in patients with paroxysmal atrial fibrillation using a single mesh catheter. J Cardiovasc Electrophysiol 2009; 20: 147-152.   53. Hofmann R, Honig S, Leisch F, Steinwender C. Pulmonary vein isolation with Mesh Ablator versus cryoballoon catheters: 6-month outcomes. J Interv Card Electrophysiol 2010; 29: 179-185.   54. Steinwender C, Honig S, Leisch F, Hofmann R. One-year followup after pulmonary vein isolation using a single mesh catheter in patients with paroxysmal atrial fibrillation. Heart Rhythm 2010; 7: 333-339.   55. Stabile G, De Ruvo E, Grimaldi M, Rovaris G, Soldati E, Anselmino M, Solimene F, Iuliano A, Sciarra L, Schillaci V, Bongiorni MG, Gaita F, Calo L. Safety and efficacy of pulmonary vein isolation using a circular, open-irrigated mapping and ablation catheter: A multicenter registry. Heart Rhythm 2015; 12: 1782-1788.   56. Kiss A, Nagy-Balo E, Sandorfi G, Edes I, Csanadi Z. Cerebral microembolization during atrial fibrillation ablation: comparison of different single-shot ablation techniques. Int J Cardiol 2014; 174: 276-281.   57. Gaita F, Leclercq JF, Schumacher B, Scaglione M, Toso E, Halimi F, Schade A, Froehner S, Ziegler V, Sergi D, Cesarani F, Blandino A. Incidence of silent cerebral thromboembolic lesions after atrial fibrillation ablation may change according to technology used: comparison of irrigated radiofrequency, multipolar nonirrigated catheter and cryoballoon. J Cardiovasc Electrophysiol 2011; 22: 961-968.   58. Herrera Siklody C, Deneke T, Hocini M, Lehrmann H, Shin DI, Miyazaki S, Henschke S, Fluegel P, Schiebeling-Romer J, Bansmann PM, Bourdias T, Dousset V, Haissaguerre M, Arentz T. Incidence of asymptomatic intracranial embolic events after pulmonary vein isolation: comparison of different atrial fibrillation ablation technologies in a multicenter study. J Am Coll Cardiol 2011; 58: 681-688.   59. Wasmer K, Foraita P, Leitz P, Guner F, Pott C, Lange PS, Eckardt L, Monnig G. Safety profile of multielectrode-phased radiofrequency pulmonary vein ablation catheter and irrigated radiofrequency catheter. Europace 2016; 18: 78-84.   60. Verma A, Debruyne P, Nardi S, Deneke T, DeGreef Y, Spitzer S, Balzer JO, Boersma L; Investigators E. Evaluation and reduction of asymptomatic cerebral embolism in ablation of atrial fibrillation, but high prevalence of chronic silent infarction: results of the evaluation of reduction of asymptomatic cerebral embolism trial. Circ Arrhythm Electrophysiol 2013; 6: 835-842.   61. Anter E, McElderry TH, Contreras-Valdes FM, Li J, Tung P, Leshem E, Haffajee CI, Nakagawa H, Josephson ME. Evaluation of a novel high-resolution mapping technology for ablation of recurrent scar-related atrial tachycardias. Heart Rhythm 2016; 13: 2048-2055.   62. Anter E, Tschabrunn CM, Contreras-Valdes FM, Li J, Josephson ME. Pulmonary vein isolation using the Rhythmia mapping system: Verification of intracardiac signals using the Orion mini-basket catheter. Heart Rhythm 2015; 12: 1927-1934.   63. Nakagawa H, Ikeda A, Sharma T, Lazzara R, Jackman WM. Rapid high resolution electroanatomical mapping: evaluation of a new system in a canine atrial linear lesion model. Circ Arrhythm Electrophysiol 2012; 5: 417-424.   64. Sporton SC, Earley MJ, Nathan AW, Schilling RJ. Electroanatomic versus fluoroscopic mapping for catheter ablation procedures: a prospective randomized study. J Cardiovasc Electrophysiol 2004; 15: 310-315.   65. Estner HL, Deisenhofer I, Luik A, Ndrepepa G, von Bary C, Zrenner B, Schmitt C. Electrical isolation of pulmonary veins in patients with atrial fibrillation: reduction of fluoroscopy exposure and procedure duration by the use of a non-fluoroscopic navigation system (NavX). Europace 2006; 8: 583-587.   66. Scaglione M, Biasco L, Caponi D, Anselmino M, Negro A, Di Donna P, Corleto A, Montefusco A, Gaita F. Visualization of multiple catheters with electroanatomical mapping reduces X-ray exposure during atrial fibrillation ablation. Europace 2011; 13: 955-962.   67. Park JH, Pak HN, Choi EJ, Jang JK, Kim SK, Choi DH, Choi JI, Hwang C, Kim YH. The relationship between endocardial voltage and regional volume in electroanatomical remodeled left atria in patients with atrial fibrillation: comparison of three-dimensional computed tomographic images and voltage mapping. J Cardiovasc Electrophysiol 2009; 20: 1349-1356.   68. Martinek M, Nesser HJ, Aichinger J, Boehm G, Purerfellner H. Impact of integration of multislice computed tomography imaging into three-dimensional electroanatomic mapping on clinical outcomes, safety, and efficacy using radiofrequency ablation for atrial fibrillation. Pacing Clin Electrophysiol 2007; 30: 1215-1223.   69. Kistler PM, Rajappan K, Harris S, Earley MJ, Richmond L, Sporton SC, Schilling RJ. The impact of image integration on catheter ablation of atrial fibrillation using electroanatomic mapping: a prospective randomized study. Eur Heart J 2008; 29: 3029-3036.   70. Filgueiras-Rama D, Estrada A, Shachar J, Castrejon S, Doiny D, Ortega M, Gang E, Merino JL. Remote magnetic navigation for accurate, real-time catheter positioning and ablation in cardiac electrophysiology procedures. J Vis Exp 2013.  71. Proietti R, Pecoraro V, Di Biase L, Natale A, Santangeli P, Viecca M, Sagone A, Galli A, Moja L, Tagliabue L. Remote magnetic with open-irrigated catheter vs. manual navigation for ablation of atrial fibrillation: a systematic review and meta-analysis. Europace 2013; 15: 1241-1248.   72. Wutzler A, Wolber T, Parwani AS, Huemer M, Attanasio P, Blaschke F, Haegeli L, Haverkamp W, Duru F, Boldt LH. Robotic ablation of atrial fibrillation with a new remote catheter system. J Interv Card Electrophysiol 2014; 40: 215-219.   73. Choi MS, Oh YS, Jang SW, Kim JH, Shin WS, Youn HJ, Jung WS, Lee MY, Seong KB. Comparison of magnetic navigation system and conventional method in catheter ablation of atrial fibrillation: is magnetic navigation system is more effective and safer than conventional method? Korean Circ J 2011; 41: 248-252.    74. Troianos CA, Hartman GS, Glas KE, Skubas NJ, Eberhardt RT, Walker JD, Reeves ST; Councils on Intraoperative E and Vascular Ultrasound of the American Society of E. Guidelines for performing ultrasound guided vascular cannulation: recommendations of the American Society of Echocardiography and the Society of Cardiovascular Anesthesiologists. J Am Soc Echocardiogr 2011; 24: 1291-1318.   75. Wynn GJ, Haq I, Hung J, Bonnett LJ, Lewis G, Webber M, Waktare JE, Modi S, Snowdon RL, Hall MC, Todd DM, Gupta D. Improving safety in catheter ablation for atrial fibrillation: a prospective study of the use of ultrasound to guide vascular access. J Cardiovasc Electrophysiol 2014; 25: 680-685.   76. Saliba W, Thomas J. Intracardiac echocardiography during catheter ablation of atrial fibrillation. Europace 2008; 10 Suppl 3: iii42-47.   77. Ferguson JD, Helms A, Mangrum JM, Mahapatra S, Mason P, Bilchick K, McDaniel G, Wiggins D, DiMarco JP. Catheter ablation of atrial fibrillation without fluoroscopy using intracardiac echocardiography and electroanatomic mapping. Circ Arrhythm Electrophysiol 2009; 2: 611-619.    78. Rostock T, Steven D, Lutomsky B, Servatius H, Drewitz I, Klemm H, Mullerleile K, Ventura R, Meinertz T, Willems S. Atrial fibrillation begets atrial fibrillation in the pulmonary veins on the impact of atrial fibrillation on the electrophysiological properties of the pulmonary veins in humans. J Am Coll Cardiol 2008; 51: 2153-2160.   79. Ishida A, Yoshida A, Kitamura H, Kubo S, Fukuzawa K, Yamashiro K, Yokoyama M. Identification of functional block line in atrial flutter using three-dimensional intracardiac echocardiography. Circ J 2003; 67: 940-944.   80. Chrispin J, Ipek EG, Habibi M, Yang E, Spragg D, Marine JE, Ashikaga H, Rickard J, Berger RD, Zimmerman SL, Calkins H, Nazarian S. Clinical predictors of cardiac magnetic resonance late gadolinium enhancement in patients with atrial fibrillation. Europace 2017; 19: 371-377.   81. Boldt A, Wetzel U, Lauschke J, Weigl J, Gummert J, Hindricks G, Kottkamp H, Dhein S. Fibrosis in left atrial tissue of patients with atrial fibrillation with and without underlying mitral valve disease. Heart 2004; 90: 400-405.    82. Platonov PG, Mitrofanova LB, Orshanskaya V, Ho SY. Structural abnormalities in atrial walls are associated with presence and persistency of atrial fibrillation but not with age. J Am Coll Cardiol 2011; 58: 2225-2232.   83. Karim R, Housden RJ, Balasubramaniam M, Chen Z, Perry D, Uddin A, Al-Beyatti Y, Palkhi E, Acheampong P, Obom S, Hennemuth A, Lu Y, Bai W, Shi W, Gao Y, Peitgen HO, Radau P, Razavi R, Tannenbaum A, Rueckert D, Cates J, Schaeffter T, Peters D, MacLeod R, Rhode K. Evaluation of current algorithms for segmentation of scar tissue from late gadolinium enhancement cardiovascular magnetic resonance of the left atrium: an open-access grand challenge. J Cardiovasc Magn Reson 2013; 15: 105.    84. Dewire J, Khurram IM, Pashakhanloo F, Spragg D, Marine JE, Berger RD, Ashikaga H, Rickard J, Zimmerman SL, Zipunnikov V, Calkins H, Nazarian S. The association of pre-existing left atrial fibrosis with clinical variables in patients referred for catheter ablation of atrial fibrillation. Clin Med Insights Cardiol 2014; 8: 25-30.    85. Khurram IM, Catanzaro JN, Zimmerman S, Zipunnikov V, Berger RD, Cheng A, Sinha S, Dewire J, Marine J, Spragg D, Ashikaga H, Halperin H, Calkins H, Nazarian S. MRI Evaluation of Radiofrequency, Cryothermal, and Laser Left Atrial Lesion Formation in Patients with Atrial Fibrillation. Pacing Clin Electrophysiol 2015; 38: 1317-1324.    86. Khurram IM, Habibi M, Gucuk Ipek E, Chrispin J, Yang E, Fukumoto K, Dewire J, Spragg DD, Marine JE, Berger RD, Ashikaga H, Rickard J, Zhang Y, Zipunnikov V, Zimmerman SL, Calkins H, Nazarian S. Left Atrial LGE and Arrhythmia Recurrence Following Pulmonary Vein Isolation for Paroxysmal and Persistent AF. JACC Cardiovasc Imaging 2016; 9: 142-148.    87. Spragg DD, Khurram I, Zimmerman SL, Yarmohammadi H, Barcelon B, Needleman M, Edwards D, Marine JE, Calkins H, Nazarian S. Initial experience with magnetic resonance imaging of atrial scar and co-registration with electroanatomic voltage mapping during atrial fibrillation: success and limitations. Heart Rhythm 2012; 9: 2003-2009.   88. Grothoff M, Piorkowski C, Eitel C, Gaspar T, Lehmkuhl L, Lucke C, Hoffmann J, Hildebrand L, Wedan S, Lloyd T, Sunnarborg D, Schnackenburg B, Hindricks G, Sommer P, Gutberlet M. MR imaging-guided electrophysiological ablation studies in humans with passive catheter tracking: initial results. Radiology 2014; 271: 695-702.   89. Nazarian S, Kolandaivelu A, Zviman MM, Meininger GR, Kato R, Susil RC, Roguin A, Dickfeld TL, Ashikaga H, Calkins H, Berger RD, Bluemke DA, Lardo AC, Halperin HR. Feasibility of real-time magnetic resonance imaging for catheter guidance in electrophysiology studies. Circulation 2008; 118: 223-229.    90. Vergara GR, Vijayakumar S, Kholmovski EG, Blauer JJ, Guttman MA, Gloschat C, Payne G, Vij K, Akoum NW, Daccarett M, McGann CJ, Macleod RS, Marrouche NF. Real-time magnetic resonance imaging-guided radiofrequency atrial ablation and visualization of lesion formation at 3 Tesla. Heart Rhythm 2011; 8: 295-303.   1. Noseworthy PA, Kapa S, Deshmukh AJ, Madhavan M, Van Houten H, Haas LR, Mulpuru SK, McLeod CJ, Asirvatham SJ, Friedman PA, Shah ND, Packer DL. Risk of stroke after catheter ablation versus cardioversion for atrial fibrillation: A propensity-matched study of 24,244 patients. Heart Rhythm 2015; 12: 1154-1161.   2. Liu Y, Zhan X, Xue Y, Deng H, Fang X, Liao H, Huang J, Liu F, Liang Y, Wei W, Wu S. Incidence and outcomes of cerebrovascular events complicating catheter ablation for atrial fibrillation. Europace 2016; 18: 1357-1365.   3. Deneke T, Jais P, Scaglione M, Schmitt R, L DIB, Christopoulos G, Schade A, Mugge A, Bansmann M, Nentwich K, Muller P, Krug J, Roos M, Halbfass P, Natale A, Gaita F, Haines D. Silent cerebral events/lesions related to atrial fibrillation ablation: a clinical review. J Cardiovasc Electrophysiol 2015; 26: 455-463.   4. Ren JF, Marchlinski FE, Callans DJ. Left atrial thrombus associated with ablation for atrial fibrillation: identification with intracardiac echocardiography. J Am Coll Cardiol 2004; 43: 1861-1867.   5. Maleki K, Mohammadi R, Hart D, Cotiga D, Farhat N, Steinberg JS. Intracardiac ultrasound detection of thrombus on transseptal sheath: incidence, treatment, and prevention. J Cardiovasc Electrophysiol 2005; 16: 561-565.   6. Sparks PB, Jayaprakash S, Vohra JK, Mond HG, Yapanis AG, Grigg LE, Kalman JM. Left atrial "stunning" following radiofrequency catheter ablation of chronic atrial flutter. J Am Coll Cardiol 1998; 32: 468-475.   7. Hoyt H, Bhonsale A, Chilukuri K, Alhumaid F, Needleman M, Edwards D, Govil A, Nazarian S, Cheng A, Henrikson CA, Sinha S, Marine JE, Berger R, Calkins H, Spragg DD. Complications arising from catheter ablation of atrial fibrillation: temporal trends and predictors. Heart Rhythm 2011; 8: 1869-1874.   8. Chilukuri K, Mayer SA, Scherr D, Dalal D, Abraham T, Henrikson CA, Cheng A, Nazarian S, Sinha S, Spragg D, Berger R, Calkins H, Marine JE. Transoesophageal echocardiography predictors of periprocedural cerebrovascular accident in patients undergoing catheter ablation of atrial fibrillation. Europace 2010; 12: 1543-1549.   9. Schernthaner C, Danmayr F, Daburger A, Eichinger J, Hammerer M, Strohmer B. High incidence of echocardiographic abnormalities of the interatrial septum in patients undergoing ablation for atrial fibrillation. Echocardiography 2013; 30: 402-406.   10. McCready JW, Nunn L, Lambiase PD, Ahsan SY, Segal OR, Rowland E, Lowe MD, Chow AW. Incidence of left atrial thrombus prior to atrial fibrillation ablation: is pre-procedural transoesophageal echocardiography mandatory? Europace 2010; 12: 927-932.   11. Puwanant S, Varr BC, Shrestha K, Hussain SK, Tang WH, Gabriel RS, Wazni OM, Bhargava M, Saliba WI, Thomas JD, Lindsay BD, Klein AL. Role of the CHADS2 score in the evaluation of thromboembolic risk in patients with atrial fibrillation undergoing transesophageal echocardiography before pulmonary vein isolation. J Am Coll Cardiol 2009; 54: 2032-2039.   12. Han JH, Shin DH, Lee HJ, Kim YJ, Lee SH, Shim J, Uhm JS, Kim JY, Chang HJ, Pak HN, Lee MH, Joung B. Routine preprocedural transesophageal echocardiography might not be necessary for stroke prevention evaluation in AF patients on anticoagulation therapy. Int J Cardiol 2013; 168: 1992-1996.   13. Calkins H, Willems S, Gerstenfeld EP, Verma A, Schilling R, Hohnloser SH, Okumura K, Serota H, Nordaby M, Guiver K, Biss B, Brouwer MA, Grimaldi M, Investigators R-C. Uninterrupted Dabigatran versus Warfarin for Ablation in Atrial Fibrillation. N Engl J Med 2017; 376: 1627-1636.   14. Kapa S, Martinez MW, Williamson EE, Ommen SR, Syed IS, Feng D, Packer DL, Brady PA. ECG-gated dual-source CT for detection of left atrial appendage thrombus in patients undergoing catheter ablation for atrial fibrillation. J Interv Card Electrophysiol 2010; 29: 75-81.   15. Hong SJ, Kim JY, Kim JB, Sung JH, Wook Kim D, Uhm JS, Lee HJ, Jin Kim Y, Pak HN, Lee MH, Joung B. Multidetector computed tomography may be an adequate screening test to reduce periprocedural stroke in atrial fibrillation ablation: a multicenter propensity-matched analysis. Heart Rhythm 2014; 11: 763-770.   16. Romero J, Husain SA, Kelesidis I, Sanz J, Medina HM, Garcia MJ. Detection of left atrial appendage thrombus by cardiac computed tomography in patients with atrial fibrillation: a meta-analysis. Circ Cardiovasc Imaging 2013; 6: 185-194.   17. Saksena S, Sra J, Jordaens L, Kusumoto F, Knight B, Natale A, Kocheril A, Nanda NC, Nagarakanti R, Simon AM, Viggiano MA, Lokhandwala T, Chandler ML, Group I-CIS. A prospective comparison of cardiac imaging using intracardiac echocardiography with transesophageal echocardiography in patients with atrial fibrillation: the intracardiac echocardiography guided cardioversion helps interventional procedures study. Circ Arrhythm Electrophysiol 2010; 3: 571-577.   18. Anter E, Silverstein J, Tschabrunn CM, Shvilkin A, Haffajee CI, Zimetbaum PJ, Buxton AE, Josephson ME, Gelfand E, Manning WJ. Comparison of intracardiac echocardiography and transesophageal echocardiography for imaging of the right and left atrial appendages. Heart Rhythm 2014; 11: 1890-1897.   19. Sriram CS, Banchs JE, Moukabary T, Moradkhan R, Gonzalez MD. Detection of left atrial thrombus by intracardiac echocardiography in patients undergoing ablation of atrial fibrillation. J Interv Card Electrophysiol 2015; 43: 227-236.   20. Kwak JJ, Pak HN, Jang JK, Kim SK, Park JH, Choi JI, Hwang C, Kim YH. Safety and convenience of continuous warfarin strategy during the periprocedural period in patients who underwent catheter ablation of atrial fibrillation. J Cardiovasc Electrophysiol 2010; 21: 620-625.   21. Di Biase L, Burkhardt JD, Santangeli P, Mohanty P, Sanchez JE, Horton R, Gallinghouse GJ, Themistoclakis S, Rossillo A, Lakkireddy D, Reddy M, Hao S, Hongo R, Beheiry S, Zagrodzky J, Rong B, Mohanty S, Elayi CS, Forleo G, Pelargonio G, Narducci ML, Dello Russo A, Casella M, Fassini G, Tondo C, Schweikert RA, Natale A. Periprocedural stroke and bleeding complications in patients undergoing catheter ablation of atrial fibrillation with different anticoagulation management: results from the Role of Coumadin in Preventing Thromboembolism in Atrial Fibrillation (AF) Patients Undergoing Catheter Ablation (COMPARE) randomized trial. Circulation 2014; 129: 2638-2644.   22. Bassiouny M, Saliba W, Rickard J, Shao M, Sey A, Diab M, Martin DO, Hussein A, Khoury M, Abi-Saleh B, Alam S, Sengupta J, Borek PP, Baranowski B, Niebauer M, Callahan T, Varma N, Chung M, Tchou PJ, Kanj M, Dresing T, Lindsay BD, Wazni O. Use of dabigatran for periprocedural anticoagulation in patients undergoing catheter ablation for atrial fibrillation. Circ Arrhythm Electrophysiol 2013; 6: 460-466.    23. Providencia R, Marijon E, Albenque JP, Combes S, Combes N, Jourda F, Hireche H, Morais J, Boveda S. Rivaroxaban and dabigatran in patients undergoing catheter ablation of atrial fibrillation. Europace 2014; 16: 1137-1144.   24. Di Biase L, Lakkireddy D, Trivedi C, Deneke T, Martinek M, Mohanty S, Mohanty P, Prakash S, Bai R, Reddy M, Gianni C, Horton R, Bailey S, Sigmund E, Derndorfer M, Schade A, Mueller P, Szoelloes A, Sanchez J, Al-Ahmad A, Hranitzky P, Gallinghouse GJ, Hongo RH, Beheiry S, Purerfellner H, Burkhardt JD, Natale A. Feasibility and safety of uninterrupted periprocedural apixaban administration in patients undergoing radiofrequency catheter ablation for atrial fibrillation: Results from a multicenter study. Heart Rhythm 2015; 12: 1162-1168.   25. Cappato R, Marchlinski FE, Hohnloser SH, Naccarelli GV, Xiang J, Wilber DJ, Ma CS, Hess S, Wells DS, Juang G, Vijgen J, Hugl BJ, Balasubramaniam R, De Chillou C, Davies DW, Fields LE, Natale A; Investigators V-A. Uninterrupted rivaroxaban vs. uninterrupted vitamin K antagonists for catheter ablation in non-valvular atrial fibrillation. Eur Heart J 2015; 36: 1805-1811.    26. Kirchhof P, Haeusler KG, Blank B, De Bono J, Callans D, Elvan A, Fetsch T, Van Gelder IC, Gentlesk P, Grimaldi M, Hansen J, Hindricks G, Al-Khalidi HR, Massaro T, Mont L, Nielsen JC, Nolker G, Piccini JP, De Potter T, Scherr D, Schotten U, Themistoclakis S, Todd D, Vijgen J, Di Biase L. Apixaban in patients at risk of stroke undergoing atrial fibrillation ablation. Eur Heart J 2018; 39: 2942-2955.    27. Briceno DF, Villablanca PA, Lupercio F, Kargoli F, Jagannath A, Londono A, Patel J, Otusanya O, Brevik J, Maraboto C, Berardi C, Krumerman A, Palma E, Kim SG, Natale A, L DIB. Clinical Impact of Heparin Kinetics During Catheter Ablation of Atrial Fibrillation: Meta-Analysis and Meta-Regression. J Cardiovasc Electrophysiol 2016; 27: 683-693.   28. Shin DG, Kim TH, Uhm JS, Kim JY, Joung B, Lee MH, Pak HN. Early Experience of Novel Oral Anticoagulants in Catheter Ablation for Atrial Fibrillation: Efficacy and Safety Comparison to Warfarin. Yonsei Med J 2016; 57: 342-349.    29. Armbruster HL, Lindsley JP, Moranville MP, Habibi M, Khurram IM, Spragg DD, Berger RD, Calkins H, Marine JE. Safety of novel oral anticoagulants compared with uninterrupted warfarin for catheter ablation of atrial fibrillation. Ann Pharmacother 2015; 49: 278-284.   30. Lakshmanadoss U, Wong WS, Kutinsky I, Khalid MR, Williamson B, Haines DE. Figure-of-eight suture for venous hemostasis in fully anticoagulated patients after atrial fibrillation catheter ablation. Indian Pacing Electrophysiol J 2017; 17: 134-139.    31. Pollack CV, Jr.., Reilly PA, Eikelboom J, Glund S, Verhamme P, Bernstein RA, Dubiel R, Huisman MV, Hylek EM, Kamphuisen PW, Kreuzer J, Levy JH, Sellke FW, Stangier J, Steiner T, Wang B, Kam CW, Weitz JI. Idarucizumab for Dabigatran Reversal. N Engl J Med 2015; 373: 511-520.   32. Majeed A, Eelde A, Agren A, Schulman S, Holmstrom M. Thromboembolic safety and efficacy of prothrombin complex concentrates in the emergency reversal of warfarin coagulopathy. Thromb Res 2012; 129: 146-151.   33. Bunch TJ, Crandall BG, Weiss JP, May HT, Bair TL, Osborn JS, Anderson JL, Muhlestein JB, Horne BD, Lappe DL, Day JD. Patients treated with catheter ablation for atrial fibrillation have long-term rates of death, stroke, and dementia similar to patients without atrial fibrillation. J Cardiovasc Electrophysiol 2011; 22: 839-845.   34. Riley MP, Zado E, Hutchinson MD, Lin D, Bala R, Garcia FC, Callans DJ, Cooper JM, Verdino RJ, Dixit S, Marchlinski FE. Risk of stroke or transient ischemic attack after atrial fibrillation ablation with oral anticoagulant use guided by ECG monitoring and pulse assessment. J Cardiovasc Electrophysiol 2014; 25: 591-659.   35. Zuern CS, Kilias A, Berlitz P, Seizer P, Gramlich M, Muller K, Duckheim M, Gawaz M, Schreieck J. Anticoagulation after catheter ablation of atrial fibrillation guided by implantable cardiac monitors. Pacing Clin Electrophysiol 2015; 38: 688-693.   36. Piccini JP, Lopes RD, Kong MH, Hasselblad V, Jackson K, Al-Khatib SM. Pulmonary vein isolation for the maintenance of sinus rhythm in patients with atrial fibrillation: a meta-analysis of randomized, controlled trials. Circ Arrhythm Electrophysiol 2009; 2: 626-633.   37. Saad EB, d'Avila A, Costa IP, Aryana A, Slater C, Costa RE, Inacio LA, Jr.., Maldonado P, Neto DM, Camiletti A, Camanho LE, Polanczyk CA. Very low risk of thromboembolic events in patients undergoing successful catheter ablation of atrial fibrillation with a CHADS2 score </=3: a long-term outcome study. Circ Arrhythm Electrophysiol 2011; 4: 615-621.   38. Asirvatham SJ, Friedman PA, Packer DL, Gersh BJ, Shah ND. Patterns of Anticoagulation Use and Cardioembolic Risk After Catheter Ablation for Atrial Fibrillation. J Am Heart Assoc 2015; 4.
39. Nuhrich JM, Kuck KH, Andresen D, Steven D, Spitzer SG, Hoffmann E, Schumacher B, Eckardt L, Brachmann J, Lewalter T, Hochadel M, Senges J, Willems S, Hoffmann BA. Oral anticoagulation is frequently discontinued after ablation of paroxysmal atrial fibrillation despite previous stroke: data from the German Ablation Registry. Clin Res Cardiol 2015; 104: 463-470.   40. Themistoclakis S, Corrado A, Marchlinski FE, Jais P, Zado E, Rossillo A, Di Biase L, Schweikert RA, Saliba WI, Horton R, Mohanty P, Patel D, Burkhardt DJ, Wazni OM, Bonso A, Callans DJ, Haissaguerre M, Raviele A, Natale A. The risk of thromboembolism and need for oral anticoagulation after successful atrial fibrillation ablation. J Am Coll Cardiol 2010; 55: 735-743.   41. Sjalander S, Holmqvist F, Smith JG, Platonov PG, Kesek M, Svensson PJ, Blomstrom-Lundqvist C, Tabrizi F, Tapanainen J, Poci D, Jonsson A, Sjalander A. Assessment of Use vs Discontinuation of Oral Anticoagulation After Pulmonary Vein Isolation in Patients With Atrial Fibrillation. JAMA Cardiol 2017; 2: 146-152.   42. Uhm JS, Won H, Joung B, Nam GB, Choi KJ, Lee MH, Kim YH, Pak HN. Safety and efficacy of switching anticoagulation to aspirin three months after successful radiofrequency catheter ablation of atrial fibrillation. Yonsei Med J 2014; 55: 1238-1245.    43. Kim DH, Lee DI, Ahn J, Lee KN, Roh SY, Shim J, Choi JI, Kim YH. Ischemic stroke risk during long-term follow up in patients with successful catheter ablation for atrial fibrillation in Korea. PLoS One 2018; 13: e0201061.    44. Di Biase L, Conti S, Mohanty P, Bai R, Sanchez J, Walton D, John A, Santangeli P, Elayi CS, Beheiry S, Gallinghouse GJ, Mohanty S, Horton R, Bailey S, Burkhardt JD, Natale A. General anesthesia reduces the prevalence of pulmonary vein reconnection during repeat ablation when compared with conscious sedation: results from a randomized study. Heart Rhythm 2011; 8: 368-72.   45. Hutchinson MD, Garcia FC, Mandel JE, Elkassabany N, Zado ES, Riley MP, Cooper JM, Bala R, Frankel DS, Lin D, Supple GE, Dixit S, Gerstenfeld EP, Callans DJ and Marchlinski FE. Efforts to enhance catheter stability improve atrial fibrillation ablation outcome. Heart Rhythm 2013; 10: 347-353.   46. Cummings JE, Schweikert RA, Saliba WI, Burkhardt JD, Kilikaslan F, Saad E, Natale A. Brief communication: atrial-esophageal fistulas after radiofrequency ablation. Ann Intern Med 2006; 144: 572-574.   47. Kim YG, Shim J, Kim DH, Choi JI, Park SW, Pak HN, Kim YH. Characteristics of atrial fibrillation patients suffering atrioesophageal fistula after radiofrequency catheter ablation. J Cardiovasc Electrophysiol 2018.  48. Shah D, Dumonceau JM, Burri H, Sunthorn H, Schroft A, GentilBaron P, Yokoyama Y, Takahashi A. Acute pyloric spasm and gastric hypomotility: an extracardiac adverse effect of percutaneous radiofrequency ablation for atrial fibrillation. J Am Coll Cardiol 2005; 46: 327-330.   49. Jang SW, Kwon BJ, Choi MS, Kim DB, Shin WS, Cho EJ, Kim JH, Oh YS, Lee MY, Rho TH, Kim JH, Lee BY, Kim HL, Jung JI, Song KS. Computed tomographic analysis of the esophagus, left atrium, and pulmonary veins: implications for catheter ablation of atrial fibrillation. J Interv Card Electrophysiol 2011; 32: 1-6.   50. Lim HW, Cogert GA, Cameron CS, Cheng VY, Sandler DA. Atrioesophageal fistula during cryoballoon ablation for atrial fibrillation. J Cardiovasc Electrophysiol 2014; 25: 208-213.   51. Neven K, Schmidt B, Metzner A, Otomo K, Nuyens D, De Potter T, Chun KR, Ouyang F, Kuck KH. Fatal end of a safety algorithm for pulmonary vein isolation with use of high-intensity focused ultrasound. Circ Arrhythm Electrophysiol 2010; 3: 260-265.   52. Contreras-Valdes FM, Heist EK, Danik SB, Barrett CD, Blendea D, Brugge WR, Ptaszek L, Ruskin JN, Mansour M. Severity of esophageal injury predicts time to healing after radiofrequency catheter ablation for atrial fibrillation. Heart Rhythm 2011; 8: 1862-1868.   53. Kuwahara T, Takahashi A, Kobori A, Miyazaki S, Takahashi Y, Takei A, Nozato T, Hikita H, Sato A, Aonuma K. Safe and effective ablation of atrial fibrillation: importance of esophageal temperature monitoring to avoid periesophageal nerve injury as a complication of pulmonary vein isolation. J Cardiovasc Electrophysiol 2009; 20: 1-6.   54. Tschabrunn CM, Silverstein J, Berzin T, Ellis E, Buxton AE, Josephson ME, Anter E. Comparison between single- and multisensor oesophageal temperature probes during atrial fibrillation ablation: thermodynamic characteristics. Europace 2015; 17: 891-897.   55. Carroll BJ, Contreras-Valdes FM, Heist EK, Barrett CD, Danik SB, Ruskin JN, Mansour M. Multi-sensor esophageal temperature probe used during radiofrequency ablation for atrial fibrillation is associated with increased intraluminal temperature detection and increased risk of esophageal injury compared to single-sensor probe. J Cardiovasc Electrophysiol 2013; 24: 958-964.   56. Kuwahara T, Takahashi A, Okubo K, Takagi K, Yamao K, Nakashima E, Kawaguchi N, Takigawa M, Watari Y, Sugiyama T, Handa K, Kimura S, Hikita H, Sato A, Aonuma K. Oesophageal cooling with ice water does not reduce the incidence of oesophageal lesions complicating catheter ablation of atrial fibrillation: randomized controlled study. Europace 2014; 16: 834-839.   57. Koruth JS, Reddy VY, Miller MA, Patel KK, Coffey JO, Fischer A, Gomes JA, Dukkipati S, D'Avila A, Mittnacht A. Mechanical esophageal displacement during catheter ablation for atrial fibrillation. J Cardiovasc Electrophysiol 2012; 23: 147-154.   58. Zellerhoff S, Lenze F, Eckardt L. Prophylactic proton pump inhibition after atrial fibrillation ablation: is there any evidence? Europace 2011; 13: 1219-1221.   59. Martinek M, Meyer C, Hassanein S, Aichinger J, Bencsik G, Schoefl R, Boehm G, Nesser HJ, Purerfellner H. Identification of a high-risk population for esophageal injury during radiofrequency catheter ablation of atrial fibrillation: procedural and anatomical considerations. Heart Rhythm 2010; 7: 1224-1230.   60. Halm U, Gaspar T, Zachaus M, Sack S, Arya A, Piorkowski C, Knigge I, Hindricks G, Husser D. Thermal esophageal lesions after radiofrequency catheter ablation of left atrial arrhythmias. Am J Gastroenterol 2010; 105: 551-556.   61. Knopp H, Halm U, Lamberts R, Knigge I, Zachaus M, Sommer P, Richter S, Bollmann A, Hindricks G, Husser D. Incidental and ablation-induced findings during upper gastrointestinal endoscopy in patients after ablation of atrial fibrillation: a retrospective study of 425 patients. Heart Rhythm 2014; 11: 574-578.   62. Singh SM, d'Avila A, Singh SK, Stelzer P, Saad EB, Skanes A, Aryana A, Chinitz JS, Kulina R, Miller MA, Reddy VY. Clinical outcomes after repair of left atrial esophageal fistulas occurring after atrial fibrillation ablation procedures. Heart Rhythm 2013; 10: 1591-1597.   63. Mohanty S. Outcomes of atrio-esophageal fistula following catheter ablation of atrial fibrillation treated with surgical repair versus esophageal stenting. J Cardiovasc Electrophysiol 2014; 25: E6.   64. Gunes MF, Gokoglan Y, L DIB, Gianni C, Mohanty S, Horton R, Bailey S, Natale A. Ablating the Posterior Heart: Cardioesophageal Fistula Complicating Radiofrequency Ablation in the Coronary Sinus. J Cardiovasc Electrophysiol 2015; 26: 1376-1378.   65. Queneherve L, Musquer N, Leaute F, Coron E. Endoscopic management of an esophagopericardial fistula after radiofrequency ablation for atrial fibrillation. World J Gastroenterol 2013; 19: 3352-3353.    66. Qadeer MA, Dumot JA, Vargo JJ, Lopez AR, Rice TW. Endoscopic clips for closing esophageal perforations: case report and pooled analysis. Gastrointest Endosc 2007; 66: 605-611.   67. Santangeli P, Di Biase L, Horton R, Burkhardt JD, Sanchez J, Al-Ahmad A, Hongo R, Beheiry S, Bai R, Mohanty P, Lewis WR, Natale A. Ablation of atrial fibrillation under therapeutic warfarin reduces periprocedural complications: evidence from a meta-analysis. Circ Arrhythm Electrophysiol 2012; 5: 302-311.   68. Hohnloser SH, Camm AJ. Safety and efficacy of dabigatran etexilate during catheter ablation of atrial fibrillation: a meta-analysis of the literature. Europace 2013; 15: 1407-1411.   69. January CT, Wann LS, Alpert JS, Calkins H, Cigarroa JE, Cleveland JC, Jr.., Conti JB, Ellinor PT, Ezekowitz MD, Field ME, Murray KT, Sacco RL, Stevenson WG, Tchou PJ, Tracy CM, Yancy CW, American College of Cardiology/American Heart Association Task Force on Practice G. 2014 AHA/ACC/HRS guideline for the management of patients with atrial fibrillation: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the Heart Rhythm Society. J Am Coll Cardiol 2014; 64: e1-76.   70. Kirchhof P, Benussi S, Kotecha D, Ahlsson A, Atar D, Casadei B, Castella M, Diener HC, Heidbuchel H, Hendriks J, Hindricks G, Manolis AS, Oldgren J, Popescu BA, Schotten U, Van Putte B, Vardas P, Agewall S, Camm J, Baron Esquivias G, Budts W, Carerj S, Casselman F, Coca A, De Caterina R, Deftereos S, Dobrev D, Ferro JM, Filippatos G, Fitzsimons D, Gorenek B, Guenoun M, Hohnloser SH, Kolh P, Lip GY, Manolis A, McMurray J, Ponikowski P, Rosenhek R, Ruschitzka F, Savelieva I, Sharma S, Suwalski P, Tamargo JL, Taylor CJ, Van Gelder IC, Voors AA, Windecker S, Zamorano JL, Zeppenfeld K. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur J Cardiothorac Surg 2016; 50: e1-e88.   71. Bin Abdulhak AA, Khan AR, Tleyjeh IM, Spertus JA, Sanders SU, Steigerwalt KE, Garbati MA, Bahmaid RA, Wimmer AP. Safety and efficacy of interrupted dabigatran for peri-procedural anticoagulation in catheter ablation of atrial fibrillation: a systematic review and meta-analysis. Europace 2013; 15: 1412-1420.   72. Chilukuri K, Henrikson CA, Dalal D, Scherr D, MacPherson EC, Cheng A, Spragg D, Nazarian S, Sinha S, Berger R, Marine JE, Calkins H. Incidence and outcomes of protamine reactions in patients undergoing catheter ablation of atrial fibrillation. J Interv Card Electrophysiol 2009; 25: 175-181.   73. European Heart Rhythm A; European Cardiac Arrhythmia S; American College of C; American Heart A; Society of Thoracic S, Calkins H, Brugada J, Packer DL, Cappato R, Chen SA, Crijns HJ, Damiano RJ, Jr.., Davies DW, Haines DE, Haissaguerre M, Iesaka Y, Jackman W, Jais P, Kottkamp H, Kuck KH, Lindsay BD, Marchlinski FE, McCarthy PM, Mont JL, Morady F, Nademanee K, Natale A, Pappone C, Prystowsky E, Raviele A, Ruskin JN, Shemin RJ. HRS/EHRA/ECAS expert Consensus Statement on catheter and surgical ablation of atrial fibrillation: recommendations for personnel, policy, procedures and follow-up. A report of the Heart Rhythm Society (HRS) Task Force on catheter and surgical ablation of atrial fibrillation. Heart Rhythm 2007; 4: 816-861.   74. Calkins H, Kuck KH, Cappato R, Brugada J, Camm AJ, Chen SA, Crijns HJ, Damiano RJ, Jr.., Davies DW, DiMarco J, Edgerton J, Ellenbogen K, Ezekowitz MD, Haines DE, Haissaguerre M, Hindricks G, Iesaka Y, Jackman W, Jalife J, Jais P, Kalman J, Keane D, Kim YH, Kirchhof P, Klein G, Kottkamp H, Kumagai K, Lindsay BD, Mansour M, Marchlinski FE, McCarthy PM, Mont JL, Morady F, Nademanee K, Nakagawa H, Natale A, Nattel S, Packer DL, Pappone C, Prystowsky E, Raviele A, Reddy V, Ruskin JN, Shemin RJ, Tsao HM, Wilber D, Heart Rhythm Society Task Force on C and Surgical Ablation of Atrial F. 2012 HRS/EHRA/ECAS expert consensus statement on catheter and surgical ablation of atrial fibrillation: recommendations for patient selection, procedural techniques, patient management and followup, definitions, endpoints, and research trial design: a report of the Heart Rhythm Society (HRS) Task Force on Catheter and Surgical Ablation of Atrial Fibrillation. Developed in partnership with the European Heart Rhythm Association (EHRA), a registered branch of the European Society of Cardiology (ESC) and the European Cardiac Arrhythmia Society (ECAS); and in collaboration with the American College of Cardiology (ACC), American Heart Association (AHA), the Asia Pacific Heart Rhythm Society (APHRS), and the Society of Thoracic Surgeons (STS). Endorsed by the governing bodies of the American College of Cardiology Foundation, the American Heart Association, the European Cardiac Arrhythmia Society, the European Heart Rhythm Association, the Society of Thoracic Surgeons, the Asia Pacific Heart Rhythm Society, and the Heart Rhythm Society. Heart Rhythm 2012; 9: 632-696 e21.   
|
|















