서론
자기공명영상(magnetic resonance imaging, MRI) 촬영은 영상의학 분야에서 가장 빠르게 성장하고 있는 표준진단법(standard of care)으로서 만성 목, 허리 통증, 연조직 종양 등의 정확한 진단을 위해 우선적으로 권장되는 진단 방법이다[1–3]. 한 임상 연구 결과 65세 이상 심박동기 이식 환자 중 85%에서 MRI 촬영이 필요한 질병이 발생할 수 있고, 이식형 제세동기 삽입 환자 중 70%가 MRI 촬영이 필요할 것이라고 예측하였다[4]. 실제 메드트로닉의 MR (magnetic resonance) conditional 기기를 이식받은 환자를 대상으로 조사한 결과 이식 후 2년 동안 20.2%의 환자가 MRI 촬영을 경험하였다는 것을 알 수 있었다. 이 환자 중 47%는 이식 전에는 MRI나 CT (computed tomography) 촬영을 경험하지 않았다[5]. 이러한 필요성을 바탕으로 MRI 촬영이 가능한 기기를 개발하기 위해 많은 노력을 하였고, 현재는 MR conditional 심박동기와 이식형 제세동기를 사용할 수 있게 되었다. 이 글을 통해 메드트로닉의 MR technology와 MRI 시행 전 기기와 관련하여 준비해야 하는 사항과 주의점을 정리해 보고자 한다.
기존 이식형 제세동기 및 심박동기 이식 환자의 MRI 촬영 위험성
MR conditional 기기가 개발되기 전 이식형 심장의료 기기를 시술한 환자 중 필요한 경우 MRI 촬영을 하였다. MRI 촬영 후 대다수는 큰 문제가 없었다. 그러나 이러한 단편적인 경험을 바탕으로 해서 심장 의료기기를 이식한 환자들의 MRI 촬영이 안전하다고 말할 수는 없을 것이다. 여러 연구나 보고에 따르면 이식형 심장 의료기기의 경우 MRI 촬영에 의해 다양한 영향을 받을 수 있으며 이는 환자의 안전에도 위협을 가할 수 있다. ‘MRI 촬영 중 2초 간 심정지(pause)가 발생했다’, ‘MRI 촬영 후 배터리의 전압이 갑자기 줄어들었다’, ‘프로그래밍이 리셋 혹은 바뀌었다’, ‘환자의 심장 수축 역치값(capture threshold)이 상승하였다’는 보고가 있다[6]. 또한 MRI 촬영 후 환자들은 장기간 추적관찰을 따로 실시하지 않았으므로 이로 인해 심장 수축 역치값의 변화를 보인 환자에 대한 우려는 더 커질 수 있다.
MRI는 정적인 자기장(static field), 구배 자기장(gradient field), 고주파장(radio frequency [RF] field)으로 구성된 3가지의 자기장을 이용하여 이미지를 만들어 낸다. 이 파장들은 이식형 심장 의료기기 시스템과 결합하여 영향을 끼친다(Table 1).
Table 1.
MRI Hazards – Active involvement in standards groups (ISO/TS 10974 published in 2012)
MRI 장비가 가지고 있는 정적인 자기장, 구배 자기장, 고주파장은 이식형 심장 의료기기와 전극선의 디자인이나 소프트웨어, 기기의 해부학적 위치 등에 따라 영향을 미치게 된다. 이러한 영향은 환자의 생명에도 위협을 줄 수 있는 위험 요인으로 작용할 수 있다.
메드트로닉의 MRI 안전성 기기 시스템 개발 역사(SureScan™ Pacing System)와 안전성 입증
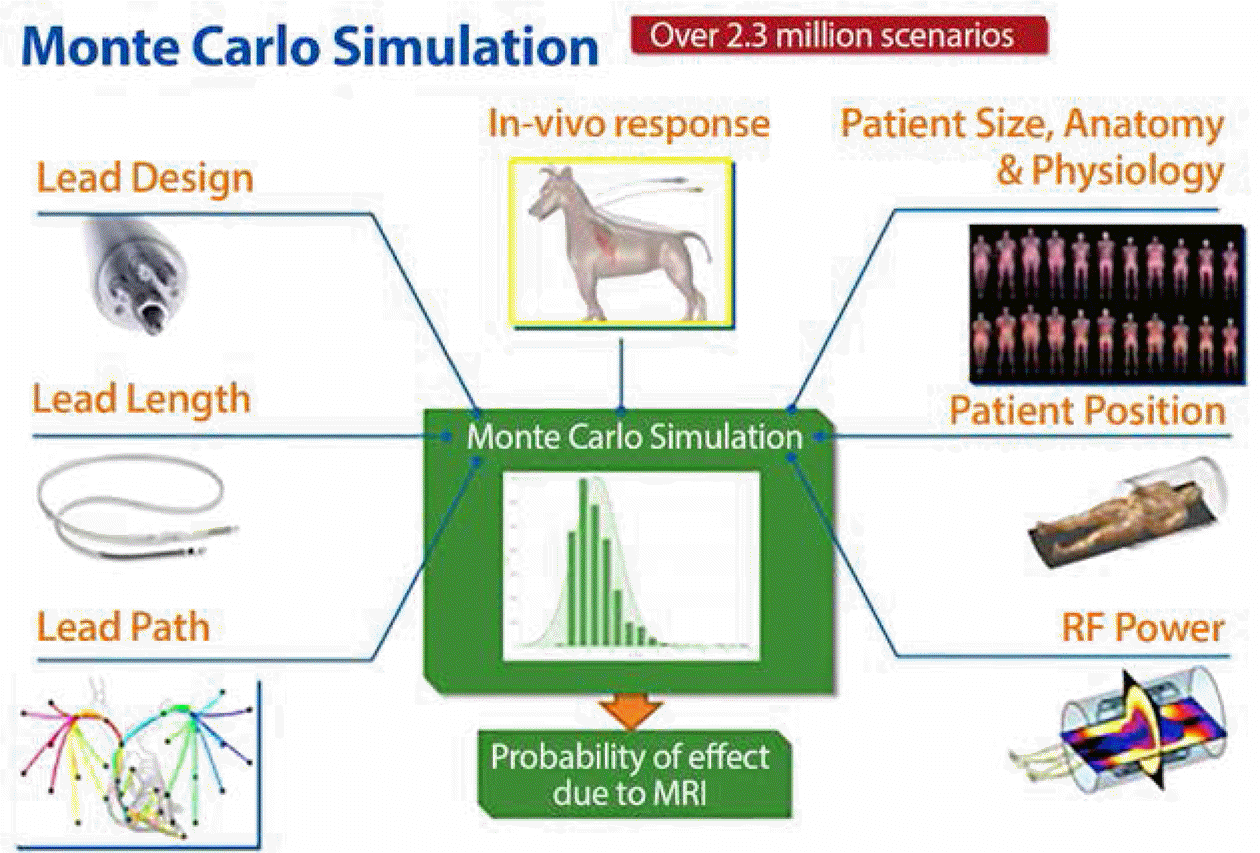
메드트로닉에서는 1997년 MRI 안전성 제품을 개발하기 위한 연구를 시작하였다. 이를 SureScan™ pacing system 이라 명명하였고, 한국에서는 현재 MR technology라고 부르고 있다. 오랜 연구 결과를 바탕으로 2001년에는 국제 전문가들과 공동으로 MR conditional 제품 기술을 개발하였으며, 2005년부터 1차적으로 완성된 제품의 원형으로 컴퓨터 모델링, 벤치 테스트, 팬텀 테스트, 동물시험 등을 통해 안전성을 검사하였다. 앞서 언급한 바와 같이 MRI 이미지를 만들어 내는 파장들은 이식형 심장 의료기기와 전극선의 디자인 및 소프트웨어, 기기의 해부학적 위치, 환자의 특징 등에 따라 여러 가지 영향을 미친다. 특히 고주파장(RF field)에 의해 발생 하는 전극선 가열(lead heating)은 결과적으로 심장 수축 역치값(pacing capture threshold)의 변화를 일으킨다. 따라서 영향을 미치는 변수인 환자의 해부학적 구조나 특징, MRI 촬영을 하는 환자의 자세 및 위치, 각 기기의 고주파장 크기, 전극선의 길이 및 구조와 들어간 위치(lead path) 등을 바탕으로 수많은 시뮬레이션을 진행하였다. 뿐만 아니라 다른 위험 요소에 대해서 각 변수의 안전성을 시뮬레이션과 동물시험 등을 통해 검증하였다.
230만회 이상의 몬테카를로 시뮬레이션(Monte Carlo simulation) 결과를 통해 MRI 촬영과 관련된 위해평가 및 안전성이 확립되었다(Figure 1). 시뮬레이션에 사용된 인체 모델링은 다양한 인종과 나이, 신체 구조 등을 반영한 400,000개의 인체 모델을 이용함으로써 당시 모델링 시나리오 중 가장 많은 수였다. 2006년에 임상 연구를 위한 디자인을 개발한 후 2007년부터 국제 다기관 임상 연구(EnRhythm MRI clinical trial)를 실시하였다[7]. 464명의 환자를 대상으로 평균 11.2±5.2개월간 추적관찰하여 안전성을 평가한 결과 MRI 관련 합병증, 부작용 등의 변화는 0%로 안전성이 입증되었다. 사용이 허가된 후에도 임상 연구는 계속 진행되었으며, 한국에서도 사용되고 있는 Advisa MRI pacemaker를 시술한 263명의 환자를 대상으로 다국적 무작위 임상 연구를 진행하였다[8]. 또한 기기를 교체할 때 일반적으로 기존의 전극선을 그대로 사용하기 때문에 266명의 환자를 대상으로 기존에 사용되던 심박동기, 제세동기의 전극선과 MRI 촬영의 안전성에 대한 임상 연구가 진행 되었다[9,10]. 연구 결과 많이 사용되었던 기존의 전극선들도 MRI 촬영 후에 안전하다는 허가를 받았다. 따라서 기기를 교체할 때 기존의 전극선에 문제가 없고, MR conditional 허가를 받은 제품이라면 MR conditional 기기로 교체한 후 MRI 촬영이 가능해졌다.
이식형 제세동기인 Evera MRI ICD (implantable cardioverter-defibrillator)에 대해서도 42개 센터, 275명의 환자를 대상으로 임상 시험이 진행되었다. 연구 결과 MRI 관련 합병증, 부작용 등의 이상 징후는 0%로 나타나 안전성이 입증 되었다[11,12]. 3,700명 이상의 환자가 임상 연구에 등록하였으며, 이 중 1,200명 이상의 환자들이 SureScan™ system의 안전성을 입증하는 임상 연장 연구에 계속 참여하였다[11]. 6년이 넘는 시간 동안 약 35만명 이상의 환자가 SureScan™ pacing system 이식형 심장 의료기기를 시술받았으며, 아직까지 이상증상 보고는 전무하다[13].
MR conditional 심박동기/이식형 제세동기(SureScan™ device & lead)
MR conditional 심박동기는 2010년 메드트로닉에서 처음으로 출시하였다(EnRhythm™ MRI SureScan™). 이후 한국에는 2012년 처음으로 소개 되었고(Advisa MRI), 현재 한국에서 사용되고 있는 메드트로닉의 MR conditional 심박동기와 이식형 제세동기는 Figure 2와 같이 Advisa MRI pacemaker, Evera™ MRI ICD로, MRI 촬영이 가능한 전극선과 SureScan™ 프로그래밍이 함께 결합하여야 MRI 촬영이 안전하다고 권고하고 있다. 현재 메드트로닉에서 제공하는 대부분의 전극선은 MR conditional 제품이다. SureScan™ pacing system과 결합하여 사용되고, 3.0 T MRI까지 사용이 가능하며, 몸 전체를 스캔할 수 있는 제품이다.
MRI 시행 전 준비해야 할 사항
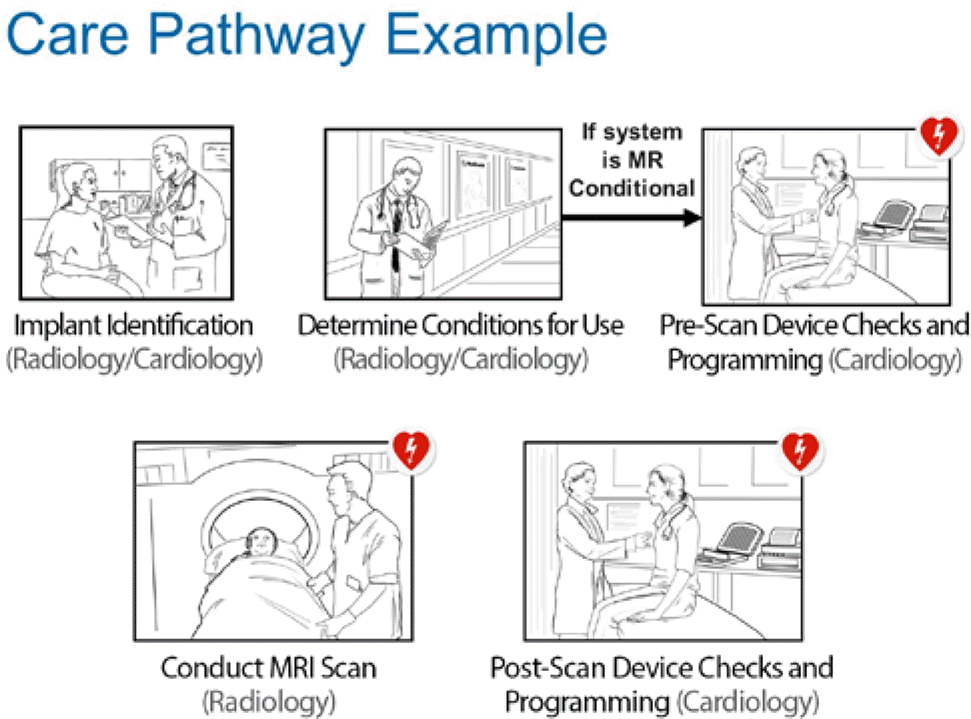
MRI 시행 전에 심장내과 전문의와 영상의학 전문의, 프로그래밍 담당자가 확인해야 할 사항은 다음과 같다. 위급한 경우가 아니라면 일반적으로 시술 약 6주 후 전극선이 안정적으로 고정되었다고 판단될 때 사용할 수 있다고 권고한다. 또한 MR conditional 기기와 전극선이 사용되었다고 해도, SureScan™ 프로그래밍이 동반되는 상태에서 안전하다고 권고하고 있다. 따라서 해당 기기를 사용하는 환자의 MRI 촬영이 불가피한 경우라면 프로그래밍 담당자를 통해 SureScan™ 프로그램을 작동할 수 있도록 해야한다.
환자가 MRI 촬영을 위해 내원하게 되면 우선 심장내과 전문의와 영상의학 전문의는 표의 체크리스트를 확인하고 환자의 상태를 점검한다(Table 2). 이후 기기 프로그래밍 담당자를 통해 SureScan™ 모드를 켜고 기타 프로그래밍이 잘 되었는지를 확인한다. MRI 촬영 하는 동안은 해당 의료진이 환자의 활력 징후를 지속적으로 관찰해야 한다. MRI 촬영을 한 후 SureScan™ 모드를 끄고 기기 점검 및 환자 상태를 관찰하면 된다(Figure 3).
Table 2.
Checklist
| Cardiology Checklist |
| Note: Patients with atrial fibrillation may be scanned if all other requirements are satisfied |
| Radiology Checklist |
| Notes: |
| Surescan™ Checklist |
결론
불과 몇 년 전만 해도 MRI 촬영이 안전한 이식형 심장 의료기기는 존재하지 않았고, 이로 인해 심박동기나 이식형 제세동기를 시술한 환자의 MRI 촬영에 대한 논란은 지속되었다. 따라서 사례별로 MRI 촬영에 따른 편익이 위험보다 우세한 경우 MRI 촬영을 하였지만 위험은 잘 파악되지 않았고, MRI 촬영의 일상적인 사용을 정당화하지 못하였다. 이식형 심장 의료기기와 MRI 촬영에 대한 경고 및 금기 사항을 없애기 위해 메드트로닉은 수많은 시뮬레이션과 전향적으로 설계되고 적절한 검정력을 갖춘 임상 연구를 여러 차례 진행하였다. 이로써 미국(Food and Drug Administration, FDA)에서 최초로 MR conditional 허가를 받은 심박동기를 출시하게 되었다. 그러나 아직은 MRI 촬영에 대한 제약이 있기에 MR conditional 기기로 분류되므로 체크리스트를 숙지하여 환자의 상태를 살펴야 하며, SureScan™ 프로그래밍을 통해 기기의 모드도 조정해야 할 필요가 있다.